Апротонный растворитель
Cтраница 3
Применение апротонных растворителей представляет интерес в тех случаях, когда протонные растворители имеют нежелательные свойства. Дефицит протонов значительно упрощает механизм электродного процесса, поэтому в апротонных растворителях для получения аналитического сигнала можно использовать такие электрохимические реакции, которые в протонных средах не идут. Однако трудности работы с этими растворителями, необходимость их тщательной очистки, применения специальных электродов сравнения и большое сопротивление растворов зачастую сводят на нет все преимущества апротонных растворителей. Следует заметить, что переход к апротонным растворителям чаще связан не с аналитическими проблемами, а с решением научных задач. [31]
У апротонных растворителей отсутствуют явно выраженные лротоно-донорные или протоно-акцепторные свойства. У них небольшая величина диэлектрической проницаемости и низкий или нулевой электрический дипольный момент. Растворенные вещества в апротонных растворителях заметно не диссоциируют. [32]
У апротонных растворителей отсутствуют явно выраженные протоно-донорные или протоно-акцепторные свойства. У них небольшая величина диэлектрической проницаемости и низкий или нулевой электрический дипольный момент. Растворенные вещества в апротонных растворителях заметно не диссоциируют. [33]
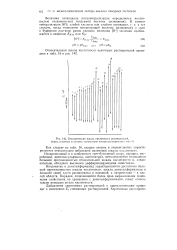 |
Относительная шкала кислотности растворителей. Цифры, указанные на рисунке, соответствуют номерам растворителей и 16. [34] |
Добавление апротонных растворителей к протолитическим приводит к изменению Es смешанных растворителей. [35]
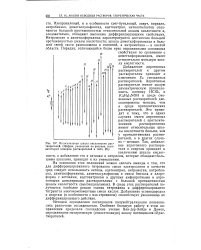 |
Относительная шкала кислотности растворителей. ( Цифры, указанные на рисунке, соответствуют номерам растворителей в 26. [36] |
Добавление апротонных растворителей к другим растворителям приводит к изменению ES смешанных растворителей. Апротонные растворители имеют малую диэлектрическую проницаемость, поэтому НС1О4 и ( CgHshNOH в среде смешанных растворителей диссоциированы меньше, чем в среде протолитических растворителей. Это приводит к тому, что в одних случаях смеси апротонных растворителей с протолити-ческими растворителями имеют относительные шкалы кислотности больше, чем у протолитических растворителей, а в других случаях - меньше. [37]
 |
Значения рК карбоновых кислот в воде и в бутаноле. [38] |
Молекулы апротонных растворителей неспособны к отщеплению протонов или к их присоединению, они не ионизированы. Растворенные в апротонных растворителях кислоты и основания также неспособны к диссоциации. Примером апротонных растворителей служит бензол. [39]
Молекулы апротонных растворителей не принимают участия в кислотно-основных равновесиях. К апро-тонным растворителям относятся хлорид фосфора ( III) РС1з, оксид азота ( IV) N2O4, ацетон, бензол и другие вещества. [40]
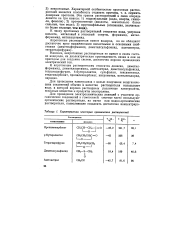 |
Характеристика некоторых органических растворителей. [41] |
К апротонным растворителям относятся диоксан, диметилформамид, диметилацетамид, ацетонитрил, диметилсульфоксид, тетрагидрофуран, 4-бутиролактон, сульфолан, гексаметапол, этиленкарбонат, пропиленкарбонат, нитрометан, метиленхлорид, пиридин. [42]
К апротонным растворителям относят химические соединения нейтрального характера, практически не способные ни отдавать, ни присоединять протоны вследствие того, что молекулы апротонного растворителя не ионизированы. [43]
К апротонным растворителям относят химические соединения нейтрального характера, практически не способные ни отдавать, ни присоединять протоны, вследствие того что молекулы апрото нного растворителя не ионизирова-нны. [44]
Между протонными и апротонными растворителями даже примерно одинаковой полярности существуют различия. Реакции неионизированных субстратов быстрее идут в протонных растворителях, которые могут образовывать водородную связь с уходящей группой. [45]
Страницы: 1 2 3 4