Диполярный апротонный растворитель
Cтраница 1
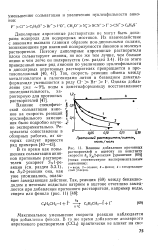 |
Влияние добавления протонных растворителей к ацетону на константу скорости &2 5 2-реакции [ уравнение ( 69 ] ( точки соответствуют экспериментальным значениям. [1] |
Диполярные апротонные растворители не могут быть донорами водорода для водородных мостиков. Их взаимодействие с анионами вызвано главным образом ион-дипольными силами, возникающими при взаимной поляризуемости а нионов и молекул растворителя. [2]
Диполярные апротонные растворители за счет специфической сольватации катиона щелочного металла способствуют диссоциации ионных пар щелочных енолятов, и тем самым способствуют реакциям с участием кислородного центра енолят-иона. [3]
Диполярные апротонные растворители - ДМФА, ДМСО, 1ФТА, ацетон, ДМАА и другие не могут образовывать водо-одные связи с анионами. Их взаимодействие с анионами вы-ю главным образом ион-дипольными силами, возникающи-при взаимной поляризуемости анионов и молекул раствори - Поэтому диполярные апротонные растворители гораздо абее сольватируют жесткие анионы небольшого размера, чем энные растворители. [4]
Диполярные апротонные растворители, такие, как ДМФ, ДМСО, ГМФА, также обладают отличной ионизирующей способностью и могут растворять неорганические соли, например соли щелочных и щелочноземельных металлов, поэтому примерно с 1950 г. их используют в реакциях нуклеофильного замещения. Молекулы этих растворителей также содержат отрицательно заряженные атомы кислорода, которые могут координировать катион металла и тем самым стабилизировать его. Они образуют так мало анионов, что активность отрицательно заряженных нуклеофильных реагентов при этом не уменьшается. Кроме того, отрицательно заряженные атомы кислорода испытывают электростатическое взаимодействие с ионами карбония, являющимися интермеди-атами в реакциях нуклеофильного замещения, причем ионизация ускоряется за счет стабилизации в результате растворения. [5]
Диполярные апротонные растворители - ДМФА, ДМСО, ГМФТА, ацетон, ДМАА и другие не могут образовывать водородные связи с анионами. Их взаимодействие с анионами вызвано главным образом ион-дипольными силами, возникающими при взаимной поляризуемости анионов и молекул растворителя. [6]
Диполярные апротонные растворители указанного типа, являясь основаниями, вытесняют из координационной сферы ионы хлора, проявляющие более слабые основные свойства. При этом образуются главным образом комплексы [ M S6 ] re, где 5 - молекула растворителя. [7]
 |
Диэлектрические проницаемости растворителей ( 20 С. [8] |
Преимущество диполярных апротонных растворителей можно увидеть на примере превращения 1 3-дихлорпропана в 1 3-дицпанпропан, протекающего по SN2 - MexaHH3My: скорость этой реакции в ДМСО примерно в 1000 раз больше, чем в водном этаноле. [9]
К диполярным апротонным растворителям относятся ацетон, метилэтилкетон, нитрометан, нитробензол, N. [10]
К диполярным апротонным растворителям ( ДАР) обычно относят алкилзамещенные амиды кислот ( М - метилформамид; N. N-диме-тилформамид, N-метилацетамид; г [ Ы - диметилацетамид; гексаме-тилфосфортриамид и др.); нитрилы ( ацетонитрил, бензонитрнл, пропионитрил, акрилонитрил - АкН, нитрил триметилуксусной кислоты и др.); кетоны ( ацетон, метилэтилкетон, метилизобутилке-тон - МИБК, диметилсульфоксид и др.) и другие соединения. Практически невозможно в книге данного объема дать полное описание всех представителей ДАР и рассмотреть реакции, протекающие в их средах. Поэтому ограничимся лишь краткими сведениями о некоторых важнейших и типичных, представителях ДАР, наиболее широко применяемыми в аналитической химии. [11]
В диполярных апротонных растворителях в процессе их взаимодействия с растворенным веществом лучше сольватируются катионы-акцепторы неподеленных пар электронов; анионы вследствие электроотрицательного характера не сольватируются совсем или сольватируются очень слабо, образуя ионные пары. [12]
Альтернативой использования диполярного апротонного растворителя является применение неполярной среды и катион-сольватирующей добавки. В обзоре 1965 г. [17] содержится предположение, что гексаметиловые эфиры цис-шю зитов должны активировать анион вследствие сольватации катиона. [13]
S для диполярных апротонных растворителей амидного типа; при этом обычное диполь-дипольное взаимодействие за счет полярных групп учитывается введением соответствующего количества инкрементов. [14]
Часто используемый термин диполярный апротонный растворитель относится, например, к таким распространенным растворителям, как диметалсульфоксид, М Г - диметал форм амид, сульфолан. [15]
Страницы: 1 2 3 4