Диполярный апротонный растворитель
Cтраница 3
Как было показано Паркером10, в диполярных апротонных растворителях ( таких, как ДМФ, диметилсульфоксид и др.) вследствие сильной сольватации катиона галоидные ионы являются как сильными основаниями, так и сильными нуклеофильными агентами. Дигалоидный ион НХ - устойчив в ДМФ1 1 и замедляет реакцию обратного присоединения протона к образовавшемуся олефину. Основность и нуклеофильность С1 - иона в ДМФ, образующегося по приведенной реакции, является, по всей вероятности, причиной наблюдаемого каталитического действия солянокислого ДМА. Это подтверждается тем, что ряд хлоридов, диссоциирующих в ДМФ с образованием Cl-иона, также ускоряют дегидрохлорирование ПВХ. С другой стороны15, соли этих металлов практически не диссоциируют в ДМФ, тем самым исключается каталитическое действие С1 - иона. [31]
По данным Заугга и Шефера, в диполярных апротонных растворителях более стабильны W - и 8 ( етфане) - формы, а в протонных средах - U-конформация. U-Форма была обнаружена только в диполярных апротонных растворителях ДМФ и диме-тилацетамиде, 8 ( мс) - формы нигде обнаружить не удалось. [32]
Чрезмерное увеличение скорости реакций нуклеофильного замещения в диполярных апротонных растворителях, которое даже с такими слабыми нуклеофилами, как ион F, позволяет достигнуть значительных скоростей замещения, в общем объясняется двумя причинами. [33]
Отсюда следует, что нуклеофильность анионов в диполярных апротонных растворителях гораздо лучше соответствует их истинной нуклеофильностн, чем это наблюдается в полярной протонной среде. [34]
Отсюда следует, что нуклеофильность анионов в диполярных апротонных растворителях гораздо лучше соответствует их истинной нуклеофильности, чем это наблюдается в полярной протонной среде. [35]
В этом аспекте очень ценными являются так называемые диполярные апротонные растворители, например диметилсульфоксид ( ДМСО) или диметилформамид ( ДМФА), НСО1Ч ( СНз) 2 - Эти жидкости хорошо растворяют полярные молекулы и соли, и с то же время гораздо менее кислотны и основны, чем вода и другие гидроксилъные растворители. [36]
Замещению способствует использование натриевой или калиевой соли, диполярного апротонного растворителя или сораствори-теля и жесткого электрофила. Исходя из калиевой соли, можно получить исключительно 1-ацил -, 1-сульфо - и 1-силилпроизводные пиррола. Пиррол можно также проацетилировать в мягких условиях, например, в присутствии имидазола, который является слабым основным катализатором. К 1-замещенным пирро-лам приводит также сопряженное присоединение пиррил-аниоиа к а, / 3-иепредельиым кетоиам и нитрилам. N-Литийпиррол и магниевое производное 12 алкилируются в обычных условиях по углероду, если ие использовать растворитель, сильно сольватирующий кати-ои металла. Пирролы с электроиоакцепториыми заместителями в кольце замещаются по атому азота гораздо легче, чем сам пиррол. [37]
F - является значительно более сильным основанием в диполярных апротонных растворителях ( см. выше и разд. [38]
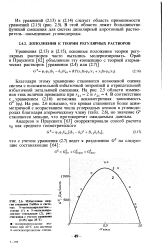 |
Избыточная энергия смешения Гиббса в системах N-метилкапролактам - гексан ( 1 и JV-метилкапро-лактам - гексадекан ( 2, рассчитанная с учетом уравнения. [39] |
В этой области лежит большинство функций смешения для систем диполярный апротонный растворитель - насыщенные углеводороды. [40]
Похоже, что Х - отчасти дезактивируется в большинстве диполярных апротонных растворителей. [41]
Увеличение реакционной способности анионов вследствие плохой их сольватации в диполярных апротонных растворителях. Правда, более правильно было бы говорить об уменьшении нуклеофильной реакционной способности анионов из-за их сильной специфической сольватации протонными растворителями, чем об увеличении ее диполярными апротонными растворителями. В диполярных апротонных растворителях сами анионы оказываются истинными нуклеофилами, тогда как в протонных растворителях они маскируются. [42]
Несмотря на то что по механизму растворения краун-эфиры подобны этим диполярным апротонным растворителям в различных органических реакциях, как подробно описано в гл. Это позволяет растворять неорганические соли в неполярных или малополярных растворителях, таких, как бензол, гексан, галогениро-ванные углеводороды, и проводить реакции в растворе в присутствии каталитического количества краун-соединения или в количестве, стехиометричес-ком по отношению к неорганической соли. [43]
Другие хорошо известные примеры повышения реакционной способности некоторых анионов в диполярных апротонных растворителях, в которых катионы сольватированы, а анионы относительно свободны от сольватации, дают мономолекулярные реакции. [44]
Большое различие в степени сольватации жестких и мягких анионов в протонных и диполярных апротонных растворителях вызывает изменение нуклеофильности анионов в этих двух классах растворителей. Ряд нуклеофильности в протонной среде соответствует изменению поляризуемости анионов, тогда как в апротонной среде он соответствует изменению основности ( т.е. сродства к протону) анионов. [45]
Страницы: 1 2 3 4