Биполярный апротонный растворитель
Cтраница 2
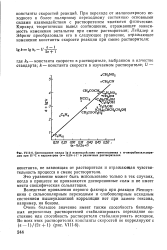 |
Соотношение между lg k взаимодействия триметиламина с л-нитробензилхлори-дом при 25 С и параметром ( г - 1 / ( 2е 1 в различных растворителях. [16] |
Очень большое значение имеет также способность биполярных апротонных растворителей стабилизировать переходное состояние или способность растворителя стабилизировать исходное. [17]
Очень большое значение имеет также способность биполярных апротонных растворителей стабилизировать переходное или исходное состояние. [18]
Нуклеофильность свободных сольватированных ионов нуклео-филов в биполярных апротонных растворителях строго пропорциональна их основности. [19]
Различия в специфической сольватации анионов в протонных и биполярных апротонных растворителях приводят к совершенно различным рядам нуклеофильности анионов. [20]
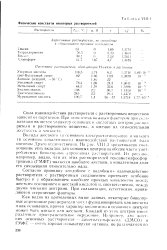 |
Физические константы некоторых растворителей. [21] |
Как видно из приведенных выше данных, некоторые биполярные апротонные растворители могут функционировать как кислоты и как основания, причем характер кислотного и основного центров может быть мягким или жестким. Каждый из этих центров имеет различное пространственное окружение. [22]
Как видно из приведенных выше данных, некоторые особенно биполярные апротонные растворители могут функционировать как кислоты и как основания, причем характер кислотного и основного центров может быть мягким или жестким. Каждый из этих центров имеет различное пространственное окружение. Например, два жестких основных растворителя - диметилсульфоксид ( ДМСО) и ГМФТ, - очень хорошо сольватируют катионы, но различаются по способности к сольватации анионов. Это объясняется тем, что в ДМСО атом серы имеет пирамидальную структуру и кислотный центр на этом атоме открыт, а ГМФТ имеет при атоме фосфора тетраэдрическую структуру и положительно заряженный атом фосфора закрыт. В итоге, хотя ДМСО имеет большую диэлектрическую проницаемость, чем ГМФТ, и, следовательно, анионы в нем содержатся в большей концентрации, чем в ГФМТ, они сольвати-рованы растворителем и поэтому менее активны. В результате реакции с участием анионов протекают в первом растворителе медленнее, чем во втором. [23]
В особенности интересна возможность при использовании фторидов фосфония в биполярных апротонных растворителях вообще обойтись без вспомогательного основания, так как фториды в этой среде проявляют высокую основность ( см. разд. [24]
Анионы, хорошо сольватируемые протонными растворителями благодаря образованию водородных связей, биполярными апротонными растворителями стабилизуются плохо. [25]
Это соединение ионизуется не только в протонных, но и в биполярных апротонных растворителях. Благодаря этому удалось значительно расширить шкалу полярности растворителей для процессов, протекающих за счет первичной ионизации исходного соединения. [26]
Это соеди-нение ионизуется не только в протонных, но и в биполярных апротонных растворителях. Благодаря этому удалось значительно расширить шкалу полярности растворителей для процессов, протекающих за счет первичной ионизации исходного соединения. [27]
В противоположность енолятам металлов простых кетонов металл-кислородная связь металлохелатов р-дикарбонильных соединений не расщепляется и в биполярных апротонных растворителях, поскольку хелатная система исключительно энергетически выгодна. Нуклеофильность кислорода остается блокированной, поэтому подобные хелаты металлов обычно реагируют в переходных. [28]
В 5-хлорантрахинонпиридине ( 23) атом галогена замещается на гидроксильную группу не только при действии солей карбоновых кислот в биполярных апротонных растворителях, но и при нагревании в самих карбоновых кислотах, например в уксусной. В реакцию вступает, по-видимому, протонированная форма соединения ( 23), обладающего высокой основностью вследствие тенденции протонированной формы к образованию внутримолекулярной водородной связи. [29]
В соединении ( 38) атом хлора замещается на гидроксигруп пу не ( Только при действии солей карбоновых кислот в биполярных апротонных растворителях, но и при нагревании в самих карбоновых кислотах, например в уксусной, путем, вероятно, атаки карбоксилат-аниона на протонированную молекулу и последующего отрыва ацил-катиона. [30]
Страницы: 1 2 3 4