Биполярный апротонный растворитель
Cтраница 3
Для замещения галогенов или нитрогруппы в активированных ароматических соединениях достаточно обработки азидом натрия в спирте или, лучше, в биполярном апротонном растворителе. [31]
Для замещения атомов галогенов или нитрогруппы в активированных ароматических соединениях достаточно обработки азидом натрия в спирте или, лучше, в биполярном апротонном растворителе. Реакция 1 3-динитро - 4-хлорбензола с азидом натрия в 25 % - м метаноле при 25 С приводит к 2 4-динитрофенил-азиду. В присутствии мицеллярного катализатора ( бромид триметилцетиламмбния) реакция протекает по каталитическому пути ( kz) в 28 раз быстрее, чем по нека-талитическому ( &i), а в присутствии трициклической аммониевой соли, в полость которой включается азид-анион, - в 128 раз быстрее. [32]
Сульфонилоксигруппы или любые другие хорошо уходящие группы, соответствующим образом расположенные в молекуле моносахарида, подвергаются бимолекулярному нуклеофильному замещению ( 5N2) кислородсодержащими нуклеофилами, такими как бензоат или ацетат, в биполярных апротонных растворителях ( например, в / У. Реакционная способность при таком замещении по механизму 5N2 зависит от природы моносахарида и места замещения. Ричардсон [43] сформулировал правило, основанное на стерео-электронных факторах в переходном состоянии, с помощью которых можно предсказать относительную реакционную способность сульфонилоксигрупп, присоединенных к пиранозному циклу. [33]
Она имеет место в протонных растворителях Н - L за счет образования водородных связей. Биполярные апротонные растворители слабо сольватируют анионы. [34]
Другим катализатором могут служить следы воды. Но биполярные апротонные растворители, взятые в большом количестве, координируются с потенциально электрофильным водородом, уменьшая его подвижность и снижая общую скорость реакции. [35]
В противоположность протонным растворителям апротонные биполярные растворители не нивелируют силу оснований. Катионы стабилизуются в биполярных апротонных растворителях гораздо лучше, чем в протонных. Влияние в общем возрастает с повышением мягкости катионов. [36]
Диметилсульфоксид широко используют в качестве растворителя - он растворяет и неорганические соли. Ввиду большой полярности его называют биполярным апротонным растворителем. Хорошо сольватирует различные катионы и тем самым активирует анионы. В растворе диметилсульфоксида хорошо протекают реакции нуклеофильного замещения. [37]
 |
Значения & Е для различных видов атомов и типов межмолекулярного взаимодействия. [38] |
Еа вводится во всех случаях при наличии полярной группы любого типа; в случае хлорированных соединений ( при наличии двух и более атомов С1, присоединенных к одному и тому же углероду) необходимо вводить 2 A. N вводится при расчете 8 для биполярных апротонных растворителей амидного типа, при этом обычно диполь-дипольное взаимодействие за счет полярных групп учитывается введением соответствующего количества инкрементов A. [39]
Если доля свободных сольватированных ионов не известна, то обычно не удается предсказать, какой ряд по еврей активности образуют нуклеофилы, так как в этих случаях основность и поляризуемость нуклеофила в неизвестных пропорциях совместно определяют нуклеофильность. В особенности это имеет место в более слабых биполярных апротонных растворителях. [40]
Вторичные сульфонилоксигруппы замещаются труднее первичных. В этом случае для успешного проведения реакции необходимо использовать биполярные апротонные растворители типа М М - диметилформамида, N-метилпйрролидона или гексаметилтриамида фосфорной кислоты [21] ( ом. Применение последнего оказывается наиболее эффективным, однако осложнения могут возникнуть на стадии выделения продуктов реакции, поскольку из-за высокой температуры кипения растворителя, удаление его путем отгонки малоэффективно. Если продукты реакции растворимы в эфире, гексаметилтриамид фосфорной кислоты можно удалить промывкой эфирного раствора водой. [41]
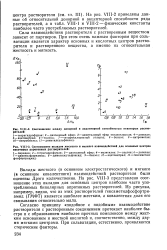 |
Соотношение между донорной и акцепторной способностью некоторых растворителей.| Соотношение вкладов жесткого и мягкого взаимодействий для основных центров некоторых апротонных растворителей. [42] |
Вклады жесткого ( в основном электростатического) и мягкого ( в основном ковалентного) взаимодействий растворителя были оценены Дрэго количественно. На рис. VIII-3 представлено соотношение этих вкладов для основных центров наиболее часто употребляемых биполярных апротонных растворителей. Из рисунка, например, видно, что из этих растворителей гексаметилфосфортри-амид ( ГМФТ) является наиболее жестким, а ковалентная доля его связывания относительно мала. [43]
Такое исследование проводили для оснований типа АгО -, так как в этом случае возможно изменение силы основания ( путем введения различных заместителей в пара-положение бензольного кольца) без существенного изменения его пространственного строения. Показано, что в случае любого основания замена гидроксилсодержащего растворителя ( Н2О или ЕЮН) биполярным апротонным растворителем, например HCONM62 ( ДМФА) или Me2S - СН ( ДМСО), очень сильно влияет на его силу; сила оснований - ОН, - OR, например, при этом чрезвычайно возрастает. Это объясняется тем, что основание в апротон-ном растворителе не имеет оболочки из молекул растворителя, связанных водородными связями, которые должны быть удалены, прежде чем частица начнет действовать как основание ( ср. [44]
Условно растворители разделяют на а п о л я р н ы е а п р о т о н - ные, биполярные апротонные и п р ото н н ы е растворители. К первой группе относят углеводороды, галогенпроизводные, третичные амины, сероуглерод; их диэлектрическая постоянная е меньше 15 и дипольный момент ц меньше 2 D. Биполярные апротонные растворители - N, Л / - дизамещенные амиды кислот, диме-тилсульфоксид, сульфоны, кетоны, нитрилы, нитропроизводные имеют е 15 и ц, 2 5 D. Протонные растворители - вода, спирты, амины, карбоновые кислоты, незамещенные амиды - являются донорами протонов при образовании водородных связей. [45]
Страницы: 1 2 3 4