Кинетическое кривое расходование
Cтраница 4
В работах [98, 99] также приведены результаты кинетических исследований разложения гербицидных мочевин под действием значительных избытков хлора. На рис. 27 представлены кинетические кривые расходования фенурона, диурона и которана под действием активного хлора в интервале рН 4 - 10 5 при 20 в условиях 10-кратного молярного избытка окислителя. [46]
Обработка экспериментальных данных, проводилась при допущении, что рассматриваемая система ( жидкость - пылевидный катализатор) является псевдогомогенной. На рис. 2 представлены кинетические кривые расходования метиловых эфиров жирноненасыщенных кислот льняного масла при температуре 220 С. [47]
Обработка экспериментальных данных проводилась при допуще - - нии, что рассматриваемая система ( жидкость - пылевидный катализатор) является псевдогомогенной. На рис. 2 представлены кинетические кривые расходования метиловых эфиров жирноненасыщенных кислот льняного масла при температуре 220 С. [48]
 |
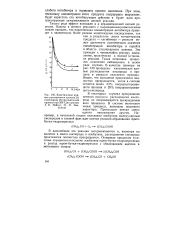
Зависимость эффективной константы скорости окисления 1 3-диоксолана гипохлоритом натрия от концентрации 1 3-диоксолана ( [ NaQO ] моль-л 1, 25 С, 1000 об / мин. [49] |
Кинетические закономерности реакции 1 3-диоксациклоалканов с гипохло-ритом натрия исследовали на примере ( /) при условии [ DH ] 0 [ NaClO ] 0, где [ DH ] 0, [ NaClO ] 0 - начальные концентрации 1 3-диоксолана и гипохлорита натрия соответственно. Показано, что в указанных условиях кинетические кривые расходования гипохлорита натрия с высоким коэффициентом корреляции г 0.99 описываются уравнением первого порядка. [50]
На рис. 1 приведены кинетические кривые расходования неозона - Д в присутствии этих фенолов. В случае первых трех фенолов на кинетических кривых расходования амина наблюдается два участка. После исчезновения фенола амин начинает расходоваться со скоростью, равной скорости инициирования радикалов в системе. В присутствии о о - незатрудненного фенола ( 2 - 71 / ет - бутилфеЕ: ол) скорость расходования неозона - Д с самого начала практически равна скорости инициирования. [51]
 |
Кинетические кривые изменения парциального давления кислорода ( /, этилена ( 2 и общего давления в системе ( 3 при окислении этилена при 300 С ( по данным Бона. [52] |
Для многомаршрутных реакций простой зависимости между изменением суммарного свойства системы и изменением концентрации отдельных компонентов не существует. В качестве примера на рис. 16 приведены кинетические кривые расходования этилена и кислорода при окислении этилена и кривая изменения давления смеси. [53]
Большое число данных свидетельствует о сложном характере кинетических кривых расходования ингибитора и сложной зависимости периода индукции от начальной концентрации ингибитора. [54]
Создание путем светового импульса ( флеш-фотолиз) или импульса быстрых электронов ( импульсный радиолиз) высокой концентрации свободных радикалов и последующая регистрация их каким-либо быстродействующим спектральным методом позволяет получать кинетические кривые расходования свободных радикалов и, тем самым, определять скорость их превращений. В этом варианте импульсных методов реакционная смесь фактически формируется под воздействием приложенного импульса. До этого в смеси свободных радикалов практически не было и какие-либо превращения отсутствовали. В принципе импульсные методы могут быть применены и для исследований в еще более коротких временных интервалах: в нано - и даже пикосекундном диапазоне. Лимитирующим фактором в этом случае становится метод регистрации происходящего химического процесса. Для этих диапазонов сегодня доминирующее значение имеют флуоресцентные методы, что, естественно, ограничивает круг процессов, доступных изучению в этих диапазонах. [55]
С явления сильного увеличения максимальной скорости реакции при низких температурах в реакторах, обработанных КС1 и КВг, по сравнению с таковой, измеренной в реакторе, обработанном борной кислотой или реакцией, и с факта изменения кинетических кривых расходования ацетальдегида, обнаруженного нами при высоких температурах. [56]
 |
Кинетические кривые расходования пропана ( / и кислорода ( 2 при окислении пропана при 200 С ( по данным 3. К. Майзус, Н. М. Эмануэля. [57] |
Это приведет к чрезвычайно резкому замедлению, практически к полной остановке реакции. В качестве примера на рис. 100 приведены кинетические кривые расходования кислорода и пропана в реакции окисления пропана. [58]
Исследования, проведенные в работе [ 31, показали, что при высоких температурах происходит изменение кинетических кривых расходования альдегида. В реакторах, обработанных KCI или КВг, максимальная скорость реакции становится во много раз ниже максимальной скорости, измеренной в сосуде, обработанном реакцией или борной кислотой. Это наглядно видно из рис. 1, на котором представлены кинетические кривые расходования ацетальдегида при 17Г и 350 С в реакторах, обработанных борной кислотой и КВг. При 350 С картина резко изменяется. Замечательным является сохранение автокаталитического характера реакции независимо от состояния поверхности реакционного сосуда. [59]
В кумоле и полистироле после облучения при 77 К стабилизируются алкильные радикалы, образовавшиеся в результате разрыва третичной С - Н - связи и прилипания атома водорода к фенильному кольцу. В интервале температур 90 - 120 К эти радикалы переходят в перекисные, взаимодействуя с растворенным кислородом. При этом общая концентрация радикалов не меняется. На рис. 1, б приведены кинетические кривые расходования радикалов R. В полистироле наблюдается характерная для твердофазных реакций ступенчатая кинетика: в изотермических условиях - кинетический эффект остановки реакции, при повышении температуры реакции начинается снова и останавливается при большей глубине превращения. Такой ход реакции можно объяснить тем, что в разных зонах полимера процесс идет с разными скоростями. При более низкой температуре наблюдается реакция в тех зонах, где она протекает с более высокой скоростью; при повышении температуры она идет и в тех областях, где ранее была затруднена. [60]
Страницы: 1 2 3 4 5