Расчет - термодинамическая характеристика
Cтраница 1
Расчет термодинамических характеристик на базе хроматогра-фических данных, полученных при повышенном давлении, осложняется двумя основными факторами: значительным отклонением свойств газовой фазы от свойств идеального газа и растворимостью газа-носителя в неподвижной фазе. В связи с этим целесообразно введение соответствующих поправок. [1]
Расчет термодинамических характеристик реальной системы сводится к расчету суммы состояния Z ( см. гл. [2]
 |
Термодинамические характеристики процесса шш лспин гелей казеина. [3] |
Расчет термодинамических характеристик процесса плавления гелей ( табл. 10) показал, что этот процесс сопровождается небольшими отрицательными изменениями свободной энергии AF ( 0 3 - 3 ккал / молъ) и большими положительными изменениями энтропии AS, как и при конформа-ционных переходах в растворах казеина. Это дает основание считать, что по мере повышения температуры проявляются гидрофобные взаимодействия, которые, возможно, и препятствуют снижению прочности гелей до нуля. [4]
Расчеты термодинамических характеристик адсорбции ряда инертных газов и предельных углеводородов цеолитом Na-X [139-143] подтверждают это. На второстепенную роль катионов при адсорбции криптона [97] и пропана [144] цеолитом Na-X указывает и отсутствие существенных изменений теплот адсорбции при блокировке нелокализованных катионов молекулами ььо. [5]
Рассмотрим расчет термодинамических характеристик на гидроалюминате кальция. Прежде всего необходимо выяснить ионный состав растворов в системе. [6]
Проведен расчет термодинамических характеристик систем в областях гомогенности и равновесного сосуществования жидкой и твердой фаз. Предложен способ оценки ожидаемых ошибок определения конечных термодинамических функций при применении метода Сторонкина - Шульца. Введена функция, характеризующая интенсивность процессов комплексообразования в тройных растворах. Проведена количественная оценка избыточной свободной энергии автокомплексообразования и взаимодействия солевых компонентов исследуемых систем. Показана взаимная согласованность полученных результатов. [7]
Проведен расчет различных термодинамических характеристик растворов CeLX2 - NH X - H20 ( X Ct br I); показана их взаимная согласованность. [8]
Для расчета термодинамических характеристик в рамках этой модели достаточно иметь решение чисто перечислительной задачи о числе способов А ( 1, Ъ) размещения на решетке графов с заданными числами / и Ъ вершин и ребер. Точное решение этой и даже более простых задач о числе А ( Г) или А ( Ъ) размещений графов, характеризуемых лишь одним из параметров I или 6, на реальных решетках не получено. [9]
Для расчета термодинамических характеристик реакций использованы данные исходных веществ, взятые из справочников и периодической литературы. [10]
Для расчета термодинамических характеристик химических реакций по способам, изложенным в предыдущем разделе, нужно знать ряд величин, определяемых экспериментально. В некоторых случаях одно ( или несколько) из необходимых исходных данных в литературе отсутствует; в этом случае приходится прибегать к менее точным методам расчета AG и Кр. Наибольшее распространение при практических расчетах находит так называемый метод структурных групп, который позволяет приближенно рассчитывать термодинамические данные. [11]
 |
Термодинамические характеристики процесса. [12] |
Для расчета остальных термодинамических характеристик процесса растворения и образования фосфата празеодима необходимо знать величину абсолютной энтропии этой соли, по которой в литературе нет никаких данных. [13]
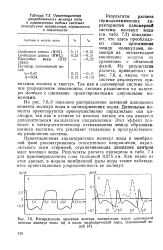 |
Распределение проекции вектора поляризации вдоль одномерной цепочки молекул воды ( а и вдоль цилиндрической поры, заполненной водой ( б. [14] |
Результаты расчета термодинамических характеристик одномерной системы молекул воды ( см. табл. 7.2) показывают, что здесь преобладают силы притяжения между молекулами, несмотря на значительное увеличение энергии по сравнению с объемной фазой. Из результатов расчета, приведенных на рис. 7.6, а, видно, что в системе реализуется ориентация голова к хвосту. Так как в одномерной системе полное упорядочение невозможно, система разделяется на кластеры молекул с одинаково ориентированными дипольными моментами. [15]
Страницы: 1 2 3 4