Молекулярно-статистический расчет
Cтраница 3
В случае адсорбции углеводородов цеолитами при нулевом заполнении были использованы более простые модели цеолитов. В работе [182] были проведены молекулярно-статистические расчеты удерживаемого объема Vm, i ( константы Генри) для молекулы этана. Для этой молекулы была принята модель в виде двух сфер - групп СН3, перекрывающихся на расстоянии длины связи С - С. Расчеты потенциальных функций были проведены для 60 направлений. На рис. 3.42 сопоставлены вычисленные в этой работе зависимости lg Vm, i от l / T для этана в полостях цеолитов NaX и NaY с экспериментальными данными. [31]
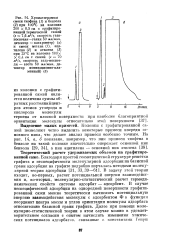
Определяя вторую производную Дц по Т, можно найти теплоемкость адсорбата. На рис. XVIII, 13 результаты молекулярно-статистического расчета зависимостей - - Др, и Qa от заполнения поверхности базисной грани графита молекулами аргона при - 195 С сопоставлены е экспериментальными данными. Это сопоставление показывает, что приближенная оценка потенциальной энергии дисперсионных сил с помощью молекулярно-статистического расчета при небольших заполнениях поверхности приводит к термодинамическим величинам, близким к измеренным. [32]
 |
Зависимость теплоты адсорбции Qa и изменения химического потенциала - Дцч от заполнения поверхности при адсорбции аргона на графите. / - результаты вычисления. [33] |
Определяя вторую производную Дц по Т, можно найти теплоемкость адсорбата. На рис. XVIII, 13 результаты молекулярно-статистического расчета зависимостей - Д ( г и Qa от заполнения поверхности базисной грани графита молекулами аргона при - 195 С сопоставлены с экспериментальными данными. Это сопоставление показывает, что приближенная оценка потенциальной энергии дисперсионных сил с помощью молекулярно-статистического расчета при небольших заполнениях поверхности приводит к термодинамическим величинам, близким к измеренным. [34]
Возникла, в частности, реальная возможность молекулярно-статистического расчета адсорбционных свойств ряда адсорбентов по отношению к множеству веществ разных классов с учетом результатов экспериментального изучения для немногих их представителей. [35]
В статье Аристова, Безуса, Березина и Си-ницына [1] приведены результаты измерений теплоемкости адсорбированных на графитированной саже бензола и и-гексана в широкой области заполнений поверхности при 293 К. Нами совместно с А. В. Киселевым и А. Я. Афреймовичем были проведены молекулярно-статистические расчеты дифференциальных изменений теплоемкости Дс0, бензола [2], метана, этана, пропана [3], к-бутана и к-пентана [4] при переходе из объема газа в адсорбированное состояние на базисной грани графита при низких заполнениях поверхности. Результаты расчетов ДСОА для этана, пропана, w - бутана и к-пентана ( в качестве силовых центров молекул приняты звенья СН3 и СН2 и использованы эффективные потенциальные функции для взаимодействия этих силовых центров с поверхностью) приведены на рисунке. [36]
В статье Аристова, Безуса, Березина и Си-ницына Ц ] приведены результаты измерений теплоемкости адсорбированных на графитированной саже бензола и н-гексана в широкой области заполнений поверхности при 293 К. Нами совместно с А. В. Киселевым и А. Я. Афреймовичем были проведены молекулярно-статистические расчеты дифференциальных изменений теплоемкости Дс, бензола [2], метана, этана, пропана [3], к-бутана и и-пентана [4] при переходе из объема газа в адсорбированное состояние на базисной грани графита при низких заполнениях поверхности. Результаты расчетов Дс0) д для этана, пропана, w - бутана и к-пентана ( в качестве силовых центров молекул приняты звенья СН3 и СН2 и использованы эффективные потенциальные функции для взаимодействия этих силовых центров с поверхностью) приведены на рисунке. [37]
Как уже было отмечено, форма атом-атомного потенциала мало влияет на результаты молекулярно-статистического расчета при соответствующем подборе параметров этого потенциала. [38]
В настоящее время решение этой проблемы значительно облегчилось благодаря применению третьего закона термодинамики и молекулярно-статистических расчетов. Однако развитие исследований химического равновесия показало, что состав равновесных смесей при высоких давлениях не отвечает вычисленному для идеальных систем. Основной проблемой термодинамики химических реакций под давлением является теперь вычисление состава равновесных смесей, представляющее собой по существу проблему уравнения состояния и теории растворов. Конкретные решения этой задачи многообразны. Их рассмотрению в значительной мере и посвящена первая часть этой книги. [39]
Полученные при анализе сложных углеводородных смесей результаты показывают, что газовая хроматография на ГТС при сопоставлении с теоретическими расчетами энергии адсорбции ( даже при делаемых в настоящее время приближениях и упрощениях) представляет ценное дополнение к другим методам структурной химии. Возможности этого метода - хроматоскопии - будут расширяться с повышением точности хроматографических измерений и молекулярно-статистического расчета ( см. разд. [40]
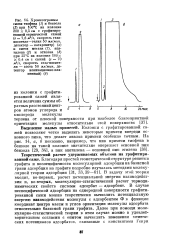 |
Хроматограммы смеси тиофена ( 1 и бензола. [41] |
В задачу этой теории входит, во-первых, расчет потенциальной энергии взаимодействия и, во-вторых, молекулярно-статистический расчет термодинамических свойств системы адсорбат - адсорбент. В случае неспецифической адсорбции на однородной поверхности графитированной сажи можно теоретически вычислить потенциальную энергию взаимодействия молекулы с адсорбентом Ф в функции координат центра массы и углов ориентации молекулы адсорбата относительно базисной грани графита. [42]
В задачу этой теории входит, во-первых, расчет потенциальной энергии взаимодействия и, во-вторых, молекулярно-статистический расчет термодинамических свойств системы адсорбат - адсорбент. В случае неспецифической адсорбции на однородной поверхности графити-рованной сажи можно теоретически вычислить потенциальную энергию взаимодействия молекулы с адсорбентом Ф в функции координат центра массы и углов ориентации молекулы адсорбата относительно базисной грани графита. [44]
 |
Значения - Д. Л ( в кДж / моль при адсорбции на хромосорбах различных веществ с газами-носителями гелием и водяным паром. [45] |
Страницы: 1 2 3 4 5