Реакция - крекинг - кумол
Cтраница 1
Реакция крекинга кумола на алюмосиликатных катализаторах в зависимости от пористости и размеров гранул осуществляется в разных областях. А, реакция протекает во внутренне-диффузионном режиме при температурах 400 - 500 С и в кинетическом режиме при более низких температурах и внутренняя переходная область при температуре выше 450 С. [1]
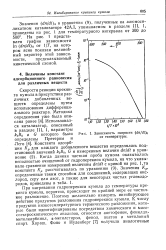 |
Зависимость скорости ( dn / dt 0 от температуры. [2] |
Скорости реакции крекинга кумола в присутствии различных добавленных веществ определены путем использования дифференциального реактора. Когда данная частная проба кумола оказывалась неполностью очищенной от гидроперекиси кумола, на что указывало сравнение измеренной величины dn / dt с кривой на рис. 1 то константа К. [3]
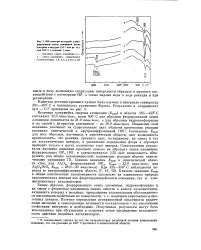 |
ИК-спектры исходной и фто-рированной окиси алюминия после прогрева в вакууме ( 10 - мм рт, ст. при 550 С в течение 1 часа. [4] |
Кинетика реакции крекинга кумола была изучена в интервале температур 385 - 495 С и подчинялась уравнению Фроста. [5]
Исследование кинетики реакции крекинга кумола на стабильном участке активности Н - эрионита дало нам возможность определить кажущуюся энергию активации, которая для этого катализатора составляла 22 ккал / моль, что значительно превышает величину, найденную для Н - фожазита - 14 5 ккал / моль. [6]
Было показано, что реакции крекинга кумола, диспропорциони-рования, изомеризации цепи и другие можно использовать для сравнения не только числа кислотных центров Бренстеда, но и числа центров Льюиса. Сравнивая константы скоростей и энергии активации перечисленных реакций, они пришли к заключению, что различия в активности катализаторов строго обусловлены общим числом кислотных центров и соотношением количеств центров Бренстеда и Льюиса. Более того, 25 % - й алюмосиликат в четыре раза активнее, чем 14 % - й, так как у них соотношение числа центров Бренстеда и Льюиса равно четырем. Эти результаты показывают, что долю активных кислотных центров можно измерить, определив каталитическую активность катализатора в любой из вышеуказанных реакций. Число кислотных центров, найденное с помощью кислотно-основных реакций, можно использовать только как приближенный показатель. Однако недостаточно установить абсолютное число кислотных центров, более важно получить данные о распределении силы кислотных центров, для того чтобы найти взаимосвязь активности катализатора в данной реакции с числом имеющихся кислотных центров. [7]
Таким образом, изучена реакция крекинга кумола и дегидратации к-бу-танола - 1 на литиевой, натриевой, калиевой и рубидиевой формах цеолита типа X. На указанных формах цеолита она принципиально не отличается от таковой на алюмосиликатном катализаторе. Установлено, что по каталитической активности литиевая форма цеолита не уступает алюмосиликат-ному катализатору. Наибольшая селективность в реакции дегидратации спиртов присуща калиевой и рубидиевой формам цеолита. [8]
Каталитическую активность изучали в реакциях крекинга кумола и легкого газойля, изомеризации м-ксц-лола и 2-метилпентена - 1, алкилирования бензола и толуола пропиленом, дегидратации спиртов. [9]
Высокая активность декатионированных катализаторов в реакции крекинга кумола обусловлена сильным сродством бензольного кольца к протону. [10]
Здесь следует добавить, что изучение реакции крекинга кумола на тех же катализаторах методом отравления привело к выводу о том, что в этом случае каталитически активными являются, вероятно, центры только одного типа - слабокислые неизолированные ОН-группы. [11]
Здесь следует добавить, что изучение реакции крекинга кумола на тех же катализаторах методом отравления привело к выводу о том, что в этом случае каталитически активными являются, вероятно, центры только одного типа - слабокислые неизолированные ОН-группы. [12]
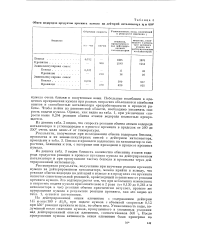 |
Обмен водородов продуктов крекинга кумола на дейтерий катализатора щ и 450. [13] |
Рассматривая результаты, полученные при изучении реакции крекинга кумола на дейтерированном катализаторе, можно прийти к выводу, что реакция обмена водорода на дейтерий в кумоле и в продуктах его крекинга является самостоятельной реакцией, происходящей независимо от реакции крекинга кумола. Это подтверждается тем, что при небольших изменениях в скоростях подачи кумола приблизительно в 2 раза ( от 0 130 до 0 264 л / л катализатора и час) реакция обмена практически затухает, процент же превращения кумола в результате реакции крекинга, как это видно из табл. 1, остается постоянным. [14]
Было изучено действие ингибиторов ( ядов) реакции крекинга кумола на алюмосиликатном катализаторе посредством интерпретации кинетических данных. Эти ингибиторы конкурируют с кумолом за место на крекирующих центрах. Теоретический анализ привел к выражению, из которого может быть рассчитана константа равновесия для адсорбции ингибитора на крекирующих центрах. Описана кинетика как для дифференциального ( Шваб) реактора, в котором концентрация реагента по существу постоянна над всем слоем катализатора, так и для интегрального реактора, в котором концентрация реагента значительно уменьшается при прохождении над слоем. [15]
Страницы: 1 2 3 4