Реакция - отрыв - водород
Cтраница 2
 |
Спектры ЭПР свободных радикалов, образующихся при реакции атомов Н. [16] |
В спиртовых матрицах при более низких температурах реакция отрыва водорода от молекул спирта, по-видимому, не происходит, хотя, как было показано в работе [259], при этой температуре атомы водорода свободно диффундируют в твердом спирте. [17]
В табл. 12.7 приведены значения относительных скоростей реакций отрыва водорода mpem - бутоксильными радикалами, источником которых был mpem - бутилгипо-хлорит. [18]
Это дает право считать, что вероятность реакции отрыва водорода от ароматического ядра меньше, чем вероятность отрыва водорода от метильной группы. [19]
Дж / моль; она снижается для реакций отрыва водорода от вторичных и третичных атомов углерода. Реакции углеводородов с атомом водорода ( при дегидрировании) экзотер-мичны, но имеют энергию активации, равную 42 кДж / моль. [20]
Это дает право считать, что вероятность реакции отрыва водорода от ароматического ядра меньше, чем вероятность отрыва водорода от метальной группы. [21]
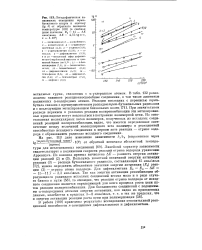 |
Логарифмическая зависимость отношения трет-бутилового спирта к ацетону ( lg А от обратного значения температуры ( в скобках даны значения Е2 15 - A. ккал / моль, А. Е 4 57 - tg ос-8, е 5 - 108. [22] |
Линейный характер зависимости свидетельствует о подчинении скорости реакций отрыва водорода уравнению Аррениуса. [23]
Рассмотрим теперь факторы, которые влияют на скорости реакций отрыва водорода. Они могут действовать в противоположных направлениях, либо ускоряя, либо замедляя реакции. [24]
На любой стадии непрерывно развивающейся окислительной деструкции могут протекать реакции отрыва водорода, что будет приводить к образованию не только различных альдегидов и кетонов, но и спиртов. [25]
На основе теории переходного состояния была предпринята попытка предсказать скорости реакций отрыва водорода. [26]
В каждом изучавшемся до настоящего времени радикальном процессе значения скоростей реакций отрыва водорода от алифатических углеводородов увеличиваются в ряду: первичныйвторичныйтретичный. [27]
Имеется много данных по относительной селективности различных атомов и - радикалов в реакциях отрыва водорода [ 8, с. В зависимости от природы радикалов, участвующих в отрыве водорода, энергия активации процесса изменяется в широком интервале: от 1 до 120 кДж / моль. Не существует прямой взаимосвязи между энергией активации и теплотой реакции. Предэкспо-ненциальные множители в уравнении Аррениуса близки к предсказываемым по теории переходного состояния и составляют примерно 1011 - 1014 л / ( моль-с) для атомов и 10В - 1010 л / ( моль-с) для простых алкильных радикалов. У незамещенных алканов относительный порядок реакционной способности соответствует ряду; третичный - вторичный - первичный углеродный атом, хотя в зависимости от природы радикала селективность может очень сильно изменяться. Заместитель в алкане, как правило, влияет лишь на ближайшие два атома углерода. Различные заместители могут по-разному дезактивировать водород в различных положениях [ 8, с. Для объяснения эффектов заместителей обычно учитывают влияние полярных, стерических и термохимических факторов. [28]
При снижении температуры и увеличении давления процесса с реакциями образования а-олефинов начинают конкурировать реакции отрыва водорода с участием высших алкильных радикалов. В результате часть а-олефинов заменяется на насыщенные углеводороды. [29]
 |
Главные пики масспектров продуктов радиолиза пропана. [30] |
Страницы: 1 2 3 4