Реакция - протонизация
Cтраница 3
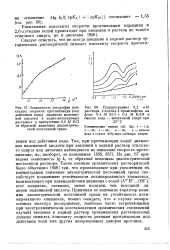
На рис. 28 прямая 1 представляет собой температурную зависимость высоты каталитической волны водорода в растворе анабазина. Было показано [124], что при более низких температурах ( правый участок прямой /) скорость процесса в целом ограничена кинетикой распада - образовавшегося на первой стадии процесса - дигидродианабазина на молекулу водорода и две молекулы анабазина; при более высоких температурах скорость этого распада увеличивается настолько, что перестает ограничивать процесс, скорость которого зависит теперь уже от реакции протонизации анабазина, протекающей с большей энергией активации. [31]
В качестве первого приближения можно принять, что изменение перенапряжения Ат ], вызванное изменением Афг, равно для нейтральных веществ Дф2 [ уравнение ( 2) гл. В этих случаях полезно отдельно изучать изменение скорости предшествующей реакции протонизации и влияние структуры двойного слоя. Скорость реакции протонизации определяется буферной емкостью, но структура двойного слоя остается неизменной, если поддерживать общую ионную силу постоянной. Влияние двойного слоя изучают, изменяя ионную силу [2]) при постоянной буферной емкости. Этот метод иллюстрируется рис. 159, на котором спад тока при больших отрицательных потенциалах вызван десорбцией восстанавливающегося вещества. Этот спад тем слабее выражен, чем больше скорость реакции протонизации. [32]
Гипотезы об образовании промежуточных мостиков, изменениях адсорбционного потенциала и точки нулевого заряда строятся на том, что ингибиторы адсорбируются в ионной форме. Однако некоторые авторы придерживаются другой точки зрения и считают, что ингибиторы действуют по молекулярному механизму. Возникающие в результате реакции протонизации органические катионы, по их мнению, существуют лишь в растворе. [33]
Особое значение имеют электродные процессы с промежуточной химической стадией, протекающей между двумя электрохимическими реакциями. Если скорость химической стадии достаточно высока, то эта стадия никак не влияет на кинетику процесса в целом, однако при замедленной промежуточной химической реакции протекание электродного процесса в большей или меньшей мере ограничивается лишь первой электрохимической реакцией, поэтому среди образующихся продуктов содержатся по меньшей мере два вещества, отвечающих полному и частичному протеканию электродного процесса. В органической электрохимии такой промежуточной реакцией чаще всего является реакция протонизации первично возникающего продукта - обычно анион-радикала или свободного радикала; последний образуется при переносе электрона на катионную ( обычно протонированную) форму деполяризатора. На полярограммах, отвечающих таким процессам в апротонной среде, первая волна, как правило, соответствует переносу одного электрона, последующие волны - дальнейшему восстановлению образовавшегося на первой стадии продукта. Величина этого дополнительного ( по сравнению с уровнем диффузионной одноэлектронной волны) кинетического тока определяется скоростью протонизации первичного продукта: с увеличением концентрации или силы доноров протонов высота кинетического тока возрастает. [34]
В книге рассматриваются электродные процессы, осложненные приэлектродными химическими реакциями и адсорбционными явлениями. В полярографии подобным процессам соответствуют кинетические и каталитические волны. Особое внимание уделено механизму и кинетике процессов, включающих реакцию протонизации. Такого рода электродные цроцессы характерны для электровосстановления органических веществ. Рассмотрено влияние строений двойного электрического слоя и адсорбции компонентов реакции на кинетику электродных процессии. Показано, как из полярографических данных могут быть вычислены константы скорости быстрых протолитических реакций. [35]
В книге рассматриваются электродные процессы, осложненные приэлектродными химическими реакциями и адсорбционными явлениями. В полярографии подобным процессам соответствуют кинетические и каталитические волны. Особое внимание уделено механизму и кинетике процессов, включающих реакцию протонизации. Такого рода электродные цроцессы характерны для электровосстановления органических веществ. Рассмотрено влияние строений двойного электрического слоя и адсорбции компонентов реакции на кинетику электродных процессов. Показано, как из полярографических данных могут быть вычислены константы скорости быстрых протолитических реакций. [36]
Фенилнитрометан восстанавливается при потенциалах, соответствующих отрицательной ветви электрокапиллярной кривой, где влияние на ifi оказывают катионы; поэтому увеличение концентрации К в растворе снижает отрицательный - потенциал ( если предположить, что точка нулевого заряда лежит при - 0 45 в, то при переходе от 0 1 к 1 0 М КС1 oj при потенциале восстановления фенилнитрометана изменяется на - 25 мв), в результате чего Е / г должен становиться положительнее на такую же величину. & / 2 / Д lgcjc - 16 же) заметно меньше, чем изменение - потенциала. Небольшая величина этого эффекта указывает, по-видимому, на то, что реакция протонизации протекает не только на поверхности, но и в объеме раствора. [37]
Из-за дефицита протонов в неводных растворах не осуществляются также и процессы предшествующей или включенной прото-низации частиц деполяризатора, чем значительно упрощается электрохимическая реакция: вместо суммарного многоэлектронного процесса наблюдаются отдельные стадии le - переходов. К тому же электрохимические процессы в неводных средах часто протекают в большей мере обратимо, чем в водных средах. Тем самым при переходе от водных к смешанным и неводным средам нередко существенно меняется механизм электрохимического процесса, причем в ряде случаев с плавным изменением протонодрнорных свойств среды электрохимический механизм меняется плавно [11] и удается проследить за кинетикой предшествующих или включенных реакций протонизации. [38]
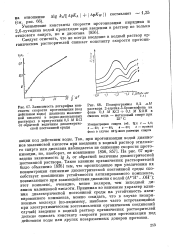
На рис. 67 приведена зависимость lg от обратной величины диэлектрической постоянной раствора. ОН -); этот комплекс, очевидно, менее полярен, чем исходный ди-анион малеиновой кислоты. Принимая во внимание характер влияния диэлектрической постоянной среды на устойчивость активированного комплекса, можно ожидать, что в случае незаряженных молекул ( по-видимому, наиболее часто встречающийся при электрохимическом восстановлении органических соединений случай) введение в водный раствор органических растворителей должно снижать константу скорости реакции протонизации под действием воды или других незаряженных доноров протонов. [40]
На рис. 67 приведена зависимость lg k от обратной величины диэлектрической постоянной раствора. ОН -); этот комплекс, очевидно, менее полярен, чем исходный ди-анион малеиновой кислоты. Принимая во внимание характер влияния диэлектрической постоянной среды на устойчивость активированного комплекса, можно ожидать, что в случае незаряженных молекул ( по-видимому, наиболее часто встречающийся при электрохимическом восстановлении органических соединений случай) введение в водный раствор органических растворителей должно снижать константу скорости реакции протонизации под действием воды или других незаряженных доноров протонов. [42]
Эта картина находится в согласии е допущением Хойтинга [159] о том, что образующийся дианион быстро и необратимо взаимодействует с растворителем. Благодаря этой реакции пик обратимого окисления меньше, чем соответствующий пик восстановления, так как часть первоначально образующегося продукта восстановления необратимо удаляется во время второй ступени восстановления. В растворителе, в котором возможна быстрая протонизация моноанионов, механизм восстановления может быть изучен поляро-графически. Реакция протонизации приводит к образованию незаряженных свободных радикалов, потенциал восстановления которых ниже, чем антрацена. [43]
Наряду с влиянием рН и ионной силы раствора механизм электродных процессов зависит и от природы растворителя. Неводные растворители в вольтамперометрии органических соединений используются не только для повышения их растворимости, но и для устранения ряда факторов, осложняющих электродный процесс. Для этого, как правило, применяют апротонные полярные растворители: ДМФА, ДМСО, ацетонитрил, тетрагидрофуран, ацетон и некоторые другие. В таких средах практически полностью подавляются реакции протонизации и ступени на вольтамперограммах соответствуют переносу электрона в более чистом виде. Кроме того, в неводных средах существенно уменьшается влияние адсорбционных эффектов, порой осложняющих форму поляризационных кривых. [44]
Фенилнитрометан восстанавливается при потенциалах, соответствующих отрицательной ветви электрокапиллярной кривой, где влияние на % оказывают катионы; поэтому увеличение концентрации К в растворе снижает отрицательный г - потенциал ( если предположить, что точка нулевого заряда лежит при - 0 45 в, то при переходе от 0 1 к 1 0 М KG1 при потенциале восстановления фенилнитрометана изменяется на - 25 мв), в результате чего Ei / t должен становиться положительнее на такую же величину. Небольшая величина этого эффекта указывает, по-видимому, на то, что реакция протонизации протекает не только на поверхности, но и в объеме раствора. [45]
Страницы: 1 2 3 4