Реакция - рекомбинация
Cтраница 2
Для реакций рекомбинации энергия активации равна нулю, поэтому они возможны в любых условиях. [16]
Роль реакций рекомбинации и диспропорционирования в радикально-цепных процессах при низких длинах кинетических цепей очень велика, так как соединения, образующиеся в результате этих реакций, могут стать основными продуктами и причиной возникновения высокомолекулярных продуктов с молекулярной массой, превышающей массу исходного соединения. [17]
Рассмотрим реакцию рекомбинации А В С - АВ С. Будем предполагать, что при реакции не происходит неадиабатических переходов и движение атомов описывается одной поверхностью потенциальной энергии. [18]
Аналогично реакциям рекомбинации ионов при возбуждении карбоновых кислот [9] протонирование возбужденных молекул ароматических углеводородов при реакции фотохимического обмена водорода должно приводить к уменьшению ( тушению) флуоресценции углеводорода и к появлению флуоресценции карбониевого иона. Тщательное изучение спектров флуоресценции ароматических углеводородов в кислых растворах показало, что действительно квантовый выход флуоресценции углеводородов уменьшается от функции кислотности. [19]
Под реакциями рекомбинации понимаются реакции образования молекулы из атомов, из атомов и радикалов или из радикалов. При этом реакции рекомбинации с участием только атомов отличаются от реакций рекомбинации с участием радикалов. Первые, как будет показано ниже, могут протекать только при тройных соударениях с молекулой или на поверхности твердого тела. Реакции рекомбинации с участием радикалов в принципе не отличаются от реакций присоединения с участием молекул. [20]
В реакциях рекомбинации третьего порядка роль третьей нейтральной частицы обычно сводится к удалению избытка энергии или углового момента. Следовательно, в тримолекулярных реакциях рекомбинации маловероятно избыточное вращательное возбуждение. Если третья частица участвует в реакции несколько больше, чем нейтральная, то можно применить подход, развитый ниже для обменных реакций с участием атомов. [21]
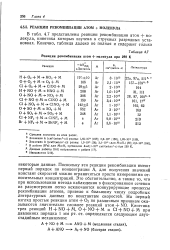 |
Реакции рекомбинации атом молекула при 298 К. [22] |
Поскольку эти реакции рекомбинации имеют первый порядок по концентрации А, для получения значений констант скоростей можно ограничиться просто измерениями относительных концентраций. Это обстоятельство, а также то, что при использовании метода наблюдения в фиксированном сечении из рассмотрения легко исключаются конкурирующие процессы рекомбинации атомов, привело к большому числу подробных литературных данных по константам скоростей. [23]
Однако при реакции рекомбинации должно выделяться большое количество энергии за счет образования двойной связи и совершенно очевидно, что молекула образующегося этилена будет в возбужденном состоянии. [24]
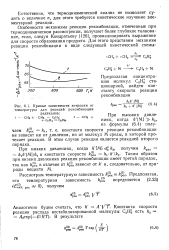 |
Кривые зависимости энтропии от. [25] |
Особенности механизма реакции рекомбинации, отмеченные при термодинамическом рассмотрении, получают более глубокое толкование, если, следуя Кондратьеву [126], проанализировать выражение для скорости образования продукта. [26]
Энергия активации реакций рекомбинации и диопропорциони-рования равна нулю, а предэкспоненциальный множитель близок к числу соударений: 1013 - 10м см3 - моль - - с-1 ( Ю-11 - 1 ( Н0 см3 - молекула - - с-1); гибель радикалов происходит при каждом или одном из пяти - десяти столкновений их. [27]
На практике реакции рекомбинации и диспропорционирования сосуществуют и конкурируют между собой, поэтому скорости диспропорционирования обычно оценивают относительно скоростей рекомбинации. Отношения констант скоростей этих реакций определяют по скорости образования олефина. Энергии активации диспропорционирования для большинства изученных радикалов близки к нулю. [28]
Большой класс гетероатомных реакций рекомбинации исследован, вообще говоря, не полностью. [29]
Одновременно с реакциями рекомбинации в системе протекают и бимолекулярные реакции между различными компонентами смеси. Как мы полагаем, величина равновесной концентрации HO2, определяемая скоростью реакции ( h), пренебрежимо мала, чтобы влиять на состав продуктов в условиях высоких температур. [30]
Страницы: 1 2 3 4