Реакция - толуол
Cтраница 4
Превращение 1, 3, 5-ксиленола в присутствии бензола происходит иначе, чем в отсутствие последнего. Более глубокое превращение ксиленола и - наличие в продуктах реакции толуола при проведении реакции в присутствии бензола указывает а то, что при этом происходит метилирование бензола за счет деметилирования ксиленола. [46]
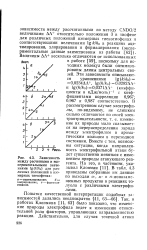 |
Зависимость между расчетными и экспериментальными значениями Ig ( k / k0 для различных положений в изомерных тиенофенах. а - а цетилярованне. б - хлорирование. в - формили-рование. [47] |
Вместе с тем, возможны ситуации, когда направленность электрофильной атаки будет существенно меняться с изменением природы атакующего реагента. В табл. 4.3 приведены собранные им данные по выходам о -, м - и п-монозаме-щенных продуктов в реакциях толуола с различными электрофилами. [48]
Обрыв цепи за счет рекомбинации атомов водорода при применявшихся условиях теоретически маловероятен. Такая же энергия активации и аналогичные продукты реакции наблюдались и при гидродеалкилирова-нии л-ксилола, но величина предэкспоненциального коэффициента была примерно вдвое больше, чем при реакции толуола. Для реакции п-ксилола энергия активации была немного меньше ( 75 ккал / моль), вероятно, вследствие гиперсопряжения; образовались высшие, чем димер, полимеры. [49]
Можно считать, что бензол, найденный в продуктах превращения смеси, своим происхождением обязан фенолу. Это доказывается тем, что выход ксилолов и триметилбензолов на превращенный толуол составляет для образца, не обработанного паром, от 30 до 10 %, причем лишь на свежем катализаторе реакция диспропорционированйя толуола протекает заметно. [50]
Алкилирование менее селективно, чем ацилирование. Например, в реакции толуола с этилбромидом при катализе GaBr3 получается 38 4 %, о-этилтолуола, 40 6 % ара-изомера и 21 0 % лета-продукта. Следовательно, даже в таком случае, когда реакция не осложнена изомеризацией, оказывается более выгодным провести ацилирование и восстановление, чем разделять смесь изомеров. [51]
Совершенно своеобразное влияние на реакцию дициклогекси-лового эфира дикарбонатной перекиси с толуолом оказывает эфи-рат трехфтористого бора. Кроме того, получены о-толилциклогексил-карбонат, циклогексанон, циклогексанол и углекислый газ. Наши опыты показали, что в отсутствие перекиси реакция толуола с эфиратом трехфтористого бора не протекает. Кроме того, в реакции с перекисью бензоила получены фенилбензоат, большое количество бензойной кислоты, углекислый газ и смолистый остаток. В реакции с перекисью ацетила кроме фенилтолилметана выделены углекислый газ, метан с примесью этана, метилацетат, уксусная кислота и толил-ацетат. Фенилтолилметан образуется не только под действием эфирата трехфтористого бора, но и в присутствии координационных соединений трехфтористого бора с диоксаном, метиловым спиртом, уксусной и фосфорной кислотами. [52]
Необходимо учитывать, что каждую из протолитических функций обычно выполняют разные части молекулы. Толуол-более сильная кислота и более сильное основание по сравнению с бензолом, но в реакции толуола с основанием прежде всего участвует метильная группа толуола, тогда как с кислотой взаимодействует исключительно его ароматическое кольцо. Что же касается кислотности ароматического кольца толуола, то она меньше, чем у незамещенного бензола, а метильная группа, в свою очередь, совершенно неактивна при обменной реакции с кислотой. [53]
Страницы: 1 2 3 4