Реакция - углерод
Cтраница 2
Большая скорость реакции углерода с кислородом объясняется тем, что на каждую молекулу реагирующего газа приблизительно два атома углерода покидают поверхность. Большая скорость реакции углерода с парами воды объясняется относительно большим значением коэффициента диффузии молекул паров воды через застойную пленку. [16]
Кинетика трех реакций углерода с О2, Н2О и СО2, очень сильно различаясь количественно, в основном одинакова, хотя адсорбция водяных паров значительно усложняет явление. [17]
Многочисленные исследования реакций углерода с газами показали, что скорость суммарного процесса ( как всякого гетерогенного процесса) определяется скоростью собственно химического реагирования и скоростью подвода газообразного реагента к реакционной поверхности, причем преимущественное влияние одного или другого фактора определяется конкретными условиями реагирования. [18]
Константа скорости реакции углерода с С02 при этой температуре по формуле (4.11) равна 3 9.10 - 6 м / с, т.е. скорость восстановления С02 пренебрежимо мала по сравнению со скоростью окисления в кипящем слое, по крайней мере пока реакция идет в кинетической области. [19]
При исследовании реакции углерода с СО2 Мейер установил следующее: до температур - 2300 К не было обнаружено заметного реагирования углерода с СО2; при температурах выше 2300 К реакция имеет нулевой порядок; энергия активации в этой области составляет - 90 ккал / моль; при температурах - 2600 К намечается стремление порядка реакции к единице, однако недостаточная воспроизводимость данных не позволяет сделать надежный вывод. [20]
Зависимость скорости реакции углерода с диоксидом углерода от температуры обработки материала имеет явно выраженный минимум в интервале температур 2600 - 2700 С. Таким образом, резкий рост размеров кристаллитов при температуре выше 2600 - 2700 С способствует повышению реакционной способности. [21]
Обсуждение порядка реакции углерода с кислородом было сознательно отложено до представления результатов по реакциям углерода с двуокисью углерода и парами воды, чтобы подчеркнуть значительное различив в экспериментальных результатах между этими реакциями. [22]
Практический интерес представляет реакция углерода с аммиаком при высокой температуре. [23]
Как и при реакции углерода с двуокисью углерода, могут быть рассмотрены механизмы А и В для случаев, где медленной стадией является или перераспределение на поверхности, или десорбция углеродо-кислородных комплексов. Это не влияет на обсуждение, за исключением того, что значение константы скорости / 9 в уравнении ( 10) меняется, как обсуждалось ранее. [24]
Второй механизм для реакции углерода с парами воды, подобный механизму В для реакции углерода с двуокисью углерода, также может иметь место. [25]
Определение энергии активации реакций углерода с газами проводилось неоднократно. Однако величины энергии активации часто неправильно интерпретировались. [26]
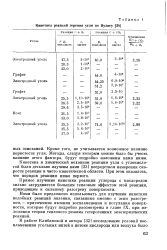 |
Кинетика реакций горения угля по Вулису. [27] |
Прямое изучение кинетики реакции углерода с кислородом сильно затрудняется большим тепловым эффектом этой реакции, приводящим к сильному разогреву поверхности. [28]
Механизм и кинетика реакций углерода с окислительными газами имеют ряд особенностей, обусловленных различиями физико-химических свойств и кристаллической структурой углеродистых материалов. Их структура и свойства определяются условиями получения и последующей термической обработки. Это позволяет использовать методы исследования механизма реакций окисления различных углеродистых материалов для изучения их структуры и ее связи с реакционными свойствами. Реакции углерода с газами в зависимости от условий могут протекать в кинетической или диффузионной областях реагирования. Поэтому для выяснения истинной реакционной способности углеродистых материалов необходим тщательный выбор этих условий для обеспечения протекания реакций в кинетической области реагирования, где скорость реакций и ее температурная зависимость будут определяться только характеристиками углеродистого материала. [29]
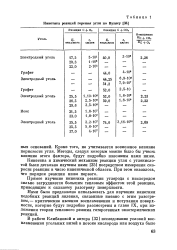 |
Кинетика реакций горения угля по Вулису. [30] |
Страницы: 1 2 3 4