Реакция - углерод
Cтраница 4
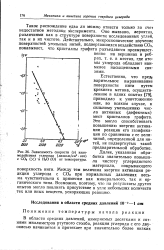 |
Зависимость скорости ( и взаимодействия углерода ( мкмоль / см3 сек с СОа ( Х и Н2О ( О от температуры. [46] |
Между тем величина энергии активации реакции углерода с СО2 при нормальных давлениях весьма чувствительна к примесям как минерального, так и органического типа. Возможно, поэтому, что на результаты других опытов могло повлиять присутствие в угле небольших количеств тех или иных веществ, ускоряющих реакцию. [47]
Правильное представление об истинном порядке реакций углерода с газами осложняется тогда, когда на скорость газификации оказывают влияние продукты реакции, обладающие тормозящим воздействием, и скорость переноса вещества реагентов к поверхности твердого тела. Торможение продуктами реакции может дать в результате слишком низкий порядок реакции, в то время как торможение переносом вещества может или повысить, или понизить кажущийся порядок в зависимости от истинного порядка реакции и закономерностей переноса вещества. Ниже в этом разделе будут даны ссылки, где можно получить сведения о порядке реакции углерода с газами. [48]
Дей [ 24, изучая реакцию углерода с кислородом при атмосферном давлении и больших скоростях газа, нашел, что отношение СО / СО2 не зависит от концентрации кислорода в пределах 37 - 99 6, мол. Он нашел также для этого температурного интервала, что отношение СО / СО2 не зависит от скорости потока при ее изменении от 51 до 305 м / сек. При немного меньших скоростях газового потока ( например, 25 4 м / сек) продукты реакции покидают поверхность углерода недостаточно быстро и заметно горение окиси углерода в газовой фазе. Например, графитизированные из ламповой сажи электроды дают при тех же самых температурах приблизительно в 7 раз меньшее отношение СО / С02, чем соответствующие неграфитизированные электроды. Дей приходит к заключению, что двуокись углерода является первичным продуктом окисления углерода. [49]
Безусловный интерес представляют данные по реакциям углерода с водородом ( Плустер и Рид), по реакциям углерода с различными газами в условиях больших скоростей и высоких температур ( Дей, Уокер и Райт) и ряд других работ как своими экспериментальными результатами, так и методическим решением вопроса. [50]
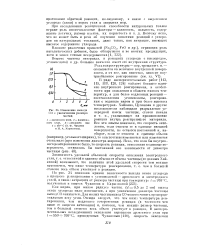 |
Изменение выхода. [51] |
Помимо чистоты материала, в реакциях углерода с кислородом, углекислотой и др. большое значение имеет его внутренняя структура. [52]
В течение последних нескольких лет изучались реакции углерода с такими газами, как кислород, двуокись углерода и водяной пар, для того чтобы определить реакционную способность различных видов углерода, а именно спектроскопически чистого электродного угля, естественного графита, кокса и активированного древесного угля, и оценить энергии активации этих реакций. Так как углерод обладает пористой структурой, то наши результаты могут иметь общий интерес для всех тех реакций газов с твердыми частицами, где диффузия в поры оказывает влияние на превращение газообразных реагентов. [53]
Выше отмечалось, что при изучении реакции углерода с газами необходимо учитывать изменение реакционной способности углеродистого материала в процессе реагирования. Однако даже в настоящее время, спустя несколько десятилетий после открытия закона внутреннего реагирования, во многих работах, где применяется вышеупомянутая методика ГОСТ 10089 - 62, влияние угара на реакционную способность углеродистых материалов не учитывается. [54]
В табл. 3 представлены относительные скорости реакций углерода с газами при 800 и 0 1 атм, рассчитанные на основании приведенных экспериментальных данных. Необходимо помнить, что это приближенные величины относительных скоростей. Однако табл. 3 показывает, что существует широкая возможность для изменения скоростей реакции углерода с газами путем выбора реагирующего газа. [55]
Страницы: 1 2 3 4