Реакция - углерод
Cтраница 3
Прямое изучение кинетики реакции углерода с кислородом сильно затрудняется большим тепловым эффектом этой реакции, приводящим к сильному разогреву поверхности. [31]
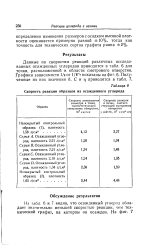 |
Скорость реакции образцов из осажденного углерода. [32] |
Данные по скоростям реакций различных исследованных осажденных углеродов приводятся в табл. 6 для точки, расположенной в области смотрового отверстия. Графики зависимости 1 / е от 1 / V / показаны на фиг. [33]
Многие работы по реакциям углерода с газами проводились с целью достичь количественной интерпретации факторов, влияющих на реакционную способность образцов угля по отношению к газам, однако в настоящее время нет ясного понимания того, почему данный образец угля в строго определенных условиях опыта реагирует с определенной скоростью с данным газом. В этом разделе вкратце обсуждаются возможные влияния ориентации кристаллитов и их размера, величины поверхности, примесей в угле, термической обработки угля, добавления галогенов к реагирующему газу и облучения на реакционную способность углерода. [34]
Известно, что для реакции углерода с кислородом легко наблюдалась чисто диффузионная область без малейшего следа каких-либо искажений, связанных с истинной кинетикой на поверхности. Это объясняется именно тем, что истинный порядок реакции ниже первого и может служить лишним доводом в пользу последнего заключения. [35]
Задача установления истинного порядка реакций углерода с газами осложняется, если на скорость газификации влияет торможение продуктами реакции и скорость переноса реагирующих веществ к поверхности твердого тела. Торможение продуктами реакции может приводить к более низким порядкам реакции, в то время как торможение, обусловленное переносом, повышает или понижает кажущийся порядок в зависимости от истинного порядка реакции и природы фактора, регулирующего процесс переноса вещества. В разделах V и VI эти усложняющие факторы будут обсуждены более подробно. Остальная часть этого раздела посвящена исследованиям порядка реакций углерода с газами. [36]
Необходимо при изучении кинетики реакции углерода с газами учитывать также роль, которую вышеуказанные стадии ( по отдельности или в сочетании друг с другом) могут играть, влияя на определяемые величины порядков реакции, энергий активации и скоростей реакций. В области катализа Тиле [100], Уилер [101, 102], Вейсс и Прейтер [103] и Франк-Каменецкий [104] много сделали для выяснения влияния стадий 2 и 3 на кинетику реакций. В этом разделе будут использованы и развиты их количественные концепции в отношении кинетики реакций углерода с газами. [37]
Наиболее важным вопросом механизма реакции углерода с кислородом является вопрос о первичных продуктах реакции: является ли двуокись углерода первичным продуктом реакции углерода с кислородом или она вторичный продукт, образующийся при окислении в газовой фазе окиси углерода. Правильное экспериментальное решение этого вопроса затрудняется наличием процесса окисления окиси углерода в газовой фазе. [38]
Другие исследователи [32, 33] наблюдали реакцию углерода с кислородом при достаточно низких температурах, когда скорость окисления окиси углерода пренебрежимо мала. [39]
Прекрасным примером реакций замещения являются реакции углерода, поэтому мы здесь рассмотрим один этот элемент. Поскольку попытка изложить в нескольких абзацах результаты многолетних исследований многих ученых была бы заведомо бесперспективной и свидетельствовала бы лишь о самоуверенности автора, то остановимся только на тех аспектах реакций у атома углерода, которые представляют интерес при обсуждении реакций у других центров. Необходимо ясно представлять себе, что между механизмами неорганических и органических реакций нет никакого фундаментального различия и любое подразделение такого рода делается лишь ради формального удобства. [40]
Обсудите тот факт, что реакция атоиарщго углерода с гра с-бутецом-2 дает три диа-стереоме ных теграметилспиропентэна в соотнощейии - 38: 37: 25, тогда как реакция с чяслбутеном-2 приводит к двум диастереоиернъш тетраметклспяропентанам в равных количествах. [41]
Обычно принято определять энергию активации реакции углерода с газами. Однако значение энергии активации часто интерпретируется неправильно. Главным образом ошибаются в оценке влияния переноса вещества на величину энергии активации. Сейчас мы остановимся на значениях величины энергии активации реакций углерода с газами, когда скорость реакции определяется только одной реакционной способностью. [42]
При определенных экспериментальных условиях скорость реакции углерода с газом ( скорость удаления атомов углерода с поверхности) зависит от реагирующего газа и природы углерода. Обсуждение влияния природы углерода на отдельные реакции углерода с газами будет проведено в разд. В этом разделе представлены существующие данные по относительным скоростям газоуглеродных реакций, в которых был использован один и тот же тип углерода. Наибольший интерес представляют те результаты, когда скорость реакции не была осложнена диффузионным торможением. [43]
Количество последнего будет определяться направлением реакций углерода с кислородом, а именно: идет ли реакция в сторону преимущественного образования окиси углерода или значительную долю конечного продукта составляет углекислота. [44]
В фиксированных экспериментальных условиях скорость реакции углерода с газом ( скорость удаления атомов углерода с поверхности) зависит от реагирующего газа и природы угля. Влияние природы угля на каждую из реакций газ - углерод по отдельности рассматривается в разделе VII. Здесь же дается обзор имеющихся данных по относительным скоростям реакций углерода с газами в тех случаях, когда изучались реакции одних и тех же образцов угля. Первостепенный интерес представляют результаты, согласно которым на скорость реакции не влияет сопротивление переносу вещества. [45]
Страницы: 1 2 3 4