Реакция - электровосстановление
Cтраница 1
 |
Часть периодической системы Д. И. Менделеева, на которой отмечены элементы, образующие при катодном растворении алкильные производные ( заштрихованы и гидриды ( подчеркнуты. [1] |
Реакция электровосстановления на катоде может идти с образованием продукта, в состав которого входит материал катода. Примером [ реакции такого типа является катодное образование металлорганических соединений, которые образуются при восстановлении карбонильных, ненасыщенных и галогенсо-держащих соединений. [2]
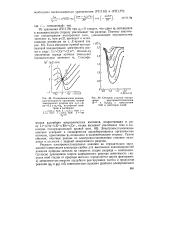 |
Поляризационные кривые, рассчитанные по уравнению теории замедленного разряда при z0 - 2, агс0 5 и i 3ir 0 на ртутном электроде в растворах.| Катодные участки поляро. [3] |
Реакция электровосстановления анионов на отрицательно заряженной поверхности электрода удобна для выяснения закономерностей влияния природы металла на скорость стадии разряда - ионизации. [4]
Реакция электровосстановления карбонильных соединений до углеводородов не имеет существенного препаративного значения, хотя она и изучена для многих соединений и в отдельных случаях протекает с высоким выходом по веществу и по току. [5]
Реакция электровосстановления азотной кислоты достаточно сложна. И, конечно, оптимальные условия ее проведения определяются не только составом раствора, подвергаемого электролизу. Не менее важен выбор материала для изготовления катода. [6]
Реакция электровосстановления карбонильных соединений до углеводородов не имеет существенного препаративного значения, хотя она и изучена для многих соединений и в отдельных случаях протекает с высоким выходом по веществу и по току. [7]
Реакции электровосстановления кислородсодержащих соединений, имеющих группировку СС-О, могут быть иллюстрированы лишь немногочисленными примерами. [8]
Реакция электровосстановления карбонильных соединений до углеводородов не имеет существенного препаративного значения, хотя она и изучена для многих соединений и в отдельных случаях протекает с высоким выходом по веществу и по току. [9]
Реакции электровосстановления органических веществ в водных средах связаны с механизмом выделения водорода на электроде и поэтому говорят о различных по своей природе восстанавливающих агентах: электронах, ионах или атомах водорода. [10]
Реакции электровосстановления кислородсодержащих соединений, имеющих группировку С С-О, могут быть иллюстрированы лишь немногочисленными примерами. [11]
Реакции электровосстановления кислородсодержащих соединений, имеющих группировку СС-О, могут быть иллюстрированы лишь немногочисленными примерами. [12]
 |
Поляризационные кривые, полученные при электролизе раствора КНОа с различными катодами. [13] |
Самые трудные реакции электровосстановления, идущие путем перезарядки и требующие больших напряжений, могут осуществляться лишь на таких металлах, как цинк, кадмий и особенно свинец и ртуть, характеризующихся большой величиной перенапряжения водорода. [14]
Протекание реакций электровосстановления в водных средах, и, вероятно, в протолитических растворителях связано с механизмом выделения водорода на данном электроде. [15]
Страницы: 1 2 3 4