Реакция - электровосстановление
Cтраница 3
Согласно поляризационным измерениям в реакции электровосстановления нитроферроцена в водных растворах с рН6 принимают участие четыре электрона, что указывает на возможное образование в качестве ее продукта ферроценилгидроксил-амина ( ФГА) CsHsFeCsH NHOH. [31]
 |
Зависимость различных видов энергии для иона На в газовой фазе от расстояния между протонами. [32] |
Так, например, в реакции электровосстановления аниона персульфата растяжение связи - OSSO-OSOjf, по-видимому, происходит в плоскости, параллельной поверхности металла. [33]
Грабовски дает объяснение автокаталитическому протеканию реакций электровосстановления NOg-иона в присутствии солей лантана, отличное от развитого С.И. Ждановым имной. В наших работах было показано, что своеобразная кинетика протекания этого процесса может быть объяснена, если учесть наряду с условиями диф-фузии к электроду каталитическое действие продукта реакции - иона гидроксила. С этой феноменологической частью теории, которой мы приписывали основное значение, Грабовски согласен. [34]
Приведенные в табл. V.10 порядки реакций электровосстановления комплексов PtCljf и PtBrl по галоген-иону согласуются с механизмом (V.47) - (V.50), если принять, что основное количество электрохимически активных комплексов образуется путем вытеснения адсорбированного галоген-иона внутрисферным ли-гандом исходного комплекса. [35]
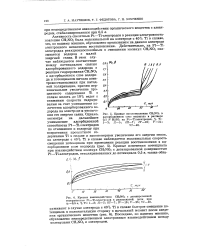 |
Кривые взаимодействия CH3NO2 с дегазированной поверхностью Pt-Ti - электродов в разомкнутой цепи при р, 0 5 в, % Ti. / - 3. II - 5. III - Т. IV-10. У-25. VI-40. [36] |
Активность скелетных Pt-Ti - электродов в реакции электровосстановления CH3NO2 была максимальной на электроде с 40 % Ti в сплаве, что, по нашему мнению, обусловлено проявлением на данном электроде электронного механизма восстановления. Действительно, на Pt-Ti - электродах реакционноспособным в отношении молекул CH3NO2 оказывается водород с малой энергией связи. В этом случае наблюдается соответствие между потенциалом снятия адсорбированного водорода в реакции гидрирования CH3N02 в адсорбционном слое водорода и потенциалом начала электровосстановления при катодной поляризации, причем первоначальное увеличение процентного содержания Ti з сплаве вплоть до 10 % ведет к снижению скорости гидрирования за счет уменьшения количества адсорбированного водорода на электроде и увеличения его энергии связи. [37]
Существуют две точки зрения на механизм реакции электровосстановления галоидозамещенных. Согласно одной из них [8, 27, 28], происходит последовательный перенос электронов, причем в качестве промежуточных продуктов образуются частицы радикального характера. [38]
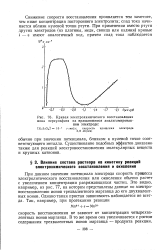 |
Кривая электрохимического восстановления. [39] |
Существование подобных эффектов доказано также для реакций электровосстановления молекулярных веществ и крупных катионов. [40]
Нас интересует влияние состава катода на реакцию электровосстановления органических соединений. [41]
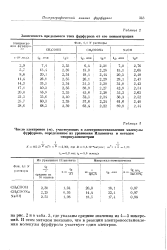 |
Зависимость предельного тока фурфурола от его концентрации. [42] |
И этим методом показано, что в реакции электровосстановления молекулы фурфурола участвует один электрон. [43]
В настоящее время обнаружена и исследована группа реакций электровосстановления, ускоряющихся при повышении концентрации ионов гидроксила. Для того чтобы понять условия протекания этих реакций, необходимо вернуться к изложенному выше объяснению действия ионов водорода. Предполагалось, что в кислой среде происходит присоединение протона к реагирующей частице со снижением ее отрицательного заряда или повышением положительного. [44]
Еще большее значение приобретают адсорбционные явления для реакций электровосстановления и электроокисления органических веществ. Без учета адсорбции было бы невозможно объяснить часто наблюдаемый кажущийся дробный порядок реакции электровосстановления. Известно, что дробный порядок характерен для гете-рогенно-каталитических процессов, протекающих с участием адсорбированных веществ. Он отражает различие между их объемными и поверхностными концентрациями. В этой связи интересно отметить, что показатель степени у объемной концентрации ацетона оказался одним и тем же и в кинетическом уравнении, описывающем процесс его электровосстановления на ртутном катоде, и в уравнении Фрейндлиха, передающем его адсорбцию на ртути. Такой результат в сочетании с данными, полученными при изучении влияния рН на кинетику процесса, позволил установить, что реакция электровосстановления ацетона на ртути в растворах кислот является реакцией первого порядка как по отношению к ацетону, так и по отношению к ионам водорода. [45]
Страницы: 1 2 3 4