Реакция - электроокисление
Cтраница 1
Реакция электроокисления SO2 - сложный процесс, который может протекать по различным путям. [1]
Реакции электроокисления гидразина и восстановления при электрохимическом механизме также протекают через промежуточные стадии. [2]
Реакция электроокисления гидразина может быть положена в основу методов кулонометрии, хронопо-тенциометрии; потенциометрии, вольтамперометрии и метода, при котором определяется предельный ток этой реакции на электроде, отделенном от раствора гидразина пористой диафрагмой. [3]
Реакции электроокисления аминов весьма сложны и, несмотря на огромное число исследований, механизмы реакций не ясны. [4]
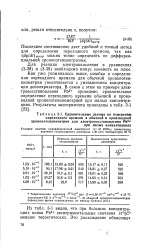 |
Сравнительные данные по измерению. [5] |
Для реакции электроокисления в уравнениях ( 3 - 38) и ( 3 - 39) необходимо минус заменить на плюс. Как уже упоминалось выше, ошибка в определении переходного времени для обычной хронопотенциометрии увеличивается с уменьшением концентрации деполяризатора. В связи с этим на примере электровосстановления РЬ2 проведено сравнительное определение переходного времени обычной и производной хронопотенциометрией при малых концентрациях. [6]
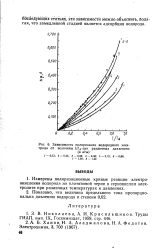 |
Зависимость поляризации водородного электрода от величины / / / при различных давлениях ( в атм. [7] |
Измерены поляризационные кривые реакции электроокисления водорода ла платиновой черни в сернокислом электролите при различных температурах и давлениях. [8]
Торможение реакций электроокисления в области ср 1 5 - 2 0 в является следствием двух причин: блокировки активных центров электрода стабильным окислом и стабилизации включенных в хемосорбционный комплекс частиц. [9]
Механизм реакции электроокисления гидразина зависит также от состава раствора. При переходе от щелочных растворов к кислым меняется кинетика и механизм реакции. [10]
Подавляющее большинство реакций электроокисления протекает через промежуточные стадии образования лабильных частиц радикального типа [1,2, 5-8]; стабильные продукты электролиза образуются путем дальнейших превращений радикалов и ион-радикалов, их взаимодействия друг с другом и компонентами раствора. [11]
Предложено объяснение реакции электроокисления водорода на платине на основе заторможенности стадии адсорбции водорода. [12]
При протекании суммарных двухэлектронных реакций электроокисления или электровосстановления Часто образуются свободные радикалы, обладающие намного более высокой стабильностью в апротонных, чем в протонодонорных растворителях. В последних свободные радикалы мгновенно протонируются и в дальнейшем восстанавливаются ( или окисляются) при потенциалах их образования. В классических работах Хойтинка [56, 57] представлены полярографические данные, относящиеся к восстановлению углеводородов в смесях диоксана с водой и чистом диоксане. После этих работ был проведен ряд исследований электроокисления и электровосстановления, часто сочетавшихся с измерениями парамагнитного резонанса. [13]
По активности в реакции электроокисления муравьиной кислоты изученные электроды можно расположить в ряд: Pd Pt - f - 4 Ru Pd - f - Ru Ru; в реакции электроокисления формиат-иона - в ряд: Pd - f - Ru Pd Pt RU Ru. Низкие перенапряжения электроокисления НСООН и НСОО - на Pd-электроде и НСОО - на Pd / Ru-электроде, а также наличие лишь незначительных количеств хемосорбированных продуктов при протекании процесса в стационарных условиях позволили сделать предположение, что в этих случаях процесс электроокисления протекает по механизму дегидрирования. Прочно хемосорбированное вещество выступает при этом в качестве неактивного побочного продукта. Филштих [67] предложил использовать сплавы платины и палладия для окисления метанола, так как присутствие в катализаторе палладия позволяет окислять образующийся в качестве промежуточного продукта НСОО с большой скоростью. [14]
Для изучения кинетики реакции электроокисления 4 - СДФА с целью выбора условий электрохимического синтеза были сняты анодные поляризационные кривые в сернокислых растворах реагента при вышеуказанных концентрациях 4 - СДФА и кислоты. [15]
Страницы: 1 2 3 4