Реакция - электроокисление
Cтраница 2
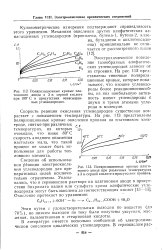 |
Поляризационные кривые платинового анода в 3 н. серной кислоте при 100 С в присутствии ненасыщенных углеводородов. [16] |
Сведения об использовании реакции электроокисления углеводородов для препаративных целей исключительно ограничены. [17]
Близкие кинетические параметры реакции электроокисления глицилглицина наблюдаются на золотом электроде в кислом и нейтральном растворах, в то время как в щелочном растворе они существенно отличаются. Потенциал полуволны реакции электроокисления глицилглицина не зависит от рН раствора. [18]
Как отмечалось выше, реакции электроокисления в этой области сопровождаются образованием в качестве промежуточных частиц радикалов и катион-радикалов. Достаточным условием возникновения частиц с неспаренным электроном является оцно электронное окисление аниона или молекулы. [19]
В данной главе рассмотрены реакции электроокисления в гидроксилсодержащих растворителях, таких, как уксусная кислота, метанол, вода и трифторуксусная кислота. Из-за ограниченного диапазона рабочих потенциалов в этих электролитных средах в качестве субстратов выбирают обычно органические соединения, окисляющиеся легче, чем используемая среда. Анодным метоксилированием был приготовлен бискеталь хино-на, который не удавалось получить классическими методами. При окислении монозамещенных бензолов, содержащих элект-роноакцепторные заместители, в трифторуксусной кислоте было продемонстрировано их орто - / шра-ориентирующее влияние. [20]
Существует еще один тип реакций электроокисления, это так называемая полимеризация анионов. [21]
Существует еще один тип реакций электроокисления, это так называемая полимеризация анионов. Примерами реакции полимеризации анионов служит: окисление сульфита в дитионат: 2SOJ3 - 2е - 2О; сульфата в персульфат: 2 SO - 2е - SaO; карбоната в перкарбонат: 2СО - 2е - - С20 и др. При этом происходит соединение двух реагирующих ионов в один, обладающий таким же зарядом, как и один из исходных ионов. [22]
Для оценки кинетических параметров реакций электроокисления проводятся измерения стационарных поляризационных кривых гальваностатическим и потешщостатическим методами. Как показывает опыт, установление постоянного потенциала при гальваностатических измерениях и постоянного тока при потенциоста-тических в большинстве случаев требует больших промежутков времени. При этом не только величины потенциалов и токов, но и наклон поляризационных кривых до установления стационарного состояния являются функциями времени измерения. [23]
Как уже отмечалось, большинство реакций электроокисления сопровождается образованием в качестве промежуточных частиц радикалов или катион-радикалов. Достаточным условием для возникновения частиц с неспаренным электроном является одноэлект-ронный переход. Установление структуры генерируемых при электроокислении радикалов имеет важнейшее значение для понимания механизма процесса. Однако в далекой анодной области использование большинства известных методов обнаружения и идентификации радикальных образований связано со значительными затруднениями. [24]
При сопоставлении активности катализаторов в реакциях электроокисления возникают трудности, вызванные тем, что наклон тафелевских зависимостей различен на разных электродах. Таким образом, порядок активности зависит от интервала потенциалов, в котором производится сравнение. [25]
Настоящая книга призвана продемонстрировать, что реакции электроокисления, в которых генерируются катион-радикалы, могут быть использованы для синтеза соединений новых классов, не доступных иными методами. [26]
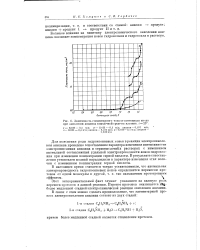 |
Зависимость стационарного тока от потев циала анода при окислении анилина в щелочной среде на платине, t 25. [27] |
Для выяснения роли гидроксониевых ионов в реакции электроокисления анилина проведено сопоставление характера изменения интенсивности электроокисления анилина в сернокислотных растворах с изменением аномальной составляющей удельной электропроводности ионов гидроксония при изменении концентрации серной кислоты. В результате сопоставления установлен полный параллелизм в характере изменения этих величин с изменением концентрации серной кислоты. [28]
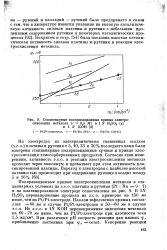 |
Стационарные поляризационные кривые алектро. [29] |
Согласно этим измерениям, активность э.с.о. в реакции электроокисления метанола проходит через максимум и превышает при этом активность платинированной платины. [30]
Страницы: 1 2 3 4