Реакция - этинилирование
Cтраница 1
Реакция этинилирования весьма успешно изучалась рядом отечественных химиков. [1]
Реакция этинилирования может рассматриваться как общий метод получения ацетиленовых спиртов из ацетилена и карбонильных соединений. [2]
 |
Этинилирование кетонов. [3] |
Реакция этинилирования представляет значительный интерес для синтеза ненасыщенных соединений, в частности терпенов, каротиноидов, стероидов. [4]
Реакция этинилирования имеет первый порядок по ацетону и зависит от концентрации ацетилена. При работе с избытком ацетилена реакция в зависимости от условий ее проведения может быть завершена за период от нескольких минут до нескольких часов. В промышленных условиях эта реакция протекает необратимо и почти количественно. Для ее прекращения нейтрализуют катализатор, после чего растворитель и избыток ацетилена разделяют путем мгновенного испарения. [5]
Реакция этинилирования представляет значительный интерес для синтеза ненасыщенных соединений, в частности терпенов, каротиноидов, стероидов. Так, например, этим путем можно получить различные тер неновые спирты ( линалоол, гераниол, фарнезол, фитол), а также витамин А ( см. стр. [6]
Реакция этинилирования представляет значительный интерес для синтеза ненасыщенных соединений, в частности терпенов, ка-ротиноидов, стероидов. Так, например, этим путем можно получить различные терпеновые спирты ( линалоол, гераниол, фарнезол, фв-тол), а также витамин А. [7]
Реакцию этинилирования для получения алкинолов и алкипдиолов лучше всего проводить при температуре 70 - 120 и давлении 5 - 20 ати в присутствии катализаторов - ацетилндов тяжелых металлов, в частности меди. Можно предполагать, что синтез алкиндиола протекает с промежуточным образованием алкинола; например, бутин-1 4-диол образуется из пропаргилового спирта как первичного продукта. [8]
Особая ценность реакции этинилирования заключается в том, что устраняется необходимость в обходном пути синтеза с применением реагентов Гриньяра, который, как известно, позволяет получать лишь стехпометри-ческие количества продуктов. [9]
Наиболее распространенным способом проведения реакции этинилирования является предложенный еще в начале века А. Е. Фаворским [33] на примере получения диметилэтинилкарбинола вариант синтеза при атмосферном давлении в среде безводных органических растворителей в присутствии более чем эквимолекулярного количества едкого кали. Синтез дегидролиналоола реализован в нашей стране на пилотной установке Калужского комбината синтетических душистых веществ. Производство ацетиленовых спиртов С15 и С20 в несколько модифицированных условиях реакции Фаворского в промышленном масштабе освоено на Болохов-ском химическом комбинате и на Ереванском витаминном заводе. [10]
Для уточнения кинетической модели реакции этинилирования было детально изучено влияние различных факторов на степень превращения ацетона в диметилэтинилкарбинол. [11]
Для предполагаемого нами механизма реакции этинилирования было выведено кинетическое уравнение и по экспериментальным данным ( табл. 51 - 53) проведена оценка кинетических констант с использованием, как и ранее, метода случайного поиска по наилучшей пробе и метода сопряженных градиентов. [12]
Алифатические кетоны вступают в реакцию этинилирования в присутствии едкого кали в качестве катализатора. [13]
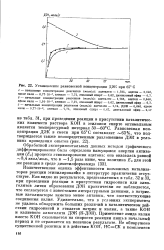 |
Установление равновесной концентрации ДЭК при 65 С. [14] |
Количественная оценка эффективности возможных катализаторов реакции этинилирования в литературе практически отсутствует. Как видно из результатов, представленных в табл. 32 и 33, при проведении реакции в присутствии гидроокиси или алко-голятов лития образования ДЭК практически не наблюдается, что согласуется с известными литературными данными, а натриевые катализаторы заметно менее активны, чем соответствующие соединения калия. Применение амида калия вместо КОН сказывается на скорости реакции лишь в начальный период и не отражается на конечном результате. [15]
Страницы: 1 2 3 4