Реакция - этинилирование
Cтраница 2
Для шести приведенных гипотетических механизмов протекания реакции этинилирования с учетом квазиравновесия быстрых стадий были составлены шесть систем кинетических дифференциальных уравнений. Так как кинетическое изучение реакции этинилирования ацетона в среде жидкого аммиака до сих пор не проводилось, то кинетические константы для этих кинетических моделей были неизвестны. [16]
Вскоре после этого развернулись интенсивные исследования реакции этинилирования ацетона с целью получения диметилацети-ленилкарбинола ( ДМАК, З - метилбутин-1 - ол - З), который уже в тот период считался важнейшим полупродуктом для последующего превращения в изопрен. Было показано, что алкоголяты кетонов, в частности ацетонат натрия или калия, в эфирном растворе, в присутствии щелочных металлов или их амидов, например амида натрия, или в отсутствие катализатора реагируют с ацетиленом с образованием ДМАК. Этот же продукт образуется при действии на ацетон моно - и дизамещенных ацетилени-дов натрия в жидком аммиаке. Гесс и Мундерлох [4] нашли, что аце-тиламид натрия взаимодействует с ацетоном в среде последнего без специального растворителя. [17]
Как уже указывалось выше, характерной особенностью реакций этинилирования является присоединение ацетилена к углеродному скелету второго реагирующего компонента с образованием новой связи С - Сие сохранением тройной связи ацетилена. Классическим примером реакции этинилирования является синтез бутин-1 4-диола из ацетилена и двух молекул водного формальдегида. [18]
Природа растворителя в сильной степени влияет на реакцию этинилирования кетонов ( см. стр. [19]
Можно было предположить, что и при проведении реакции этинилирования в среде жидкого аммиака главными побочными процессами окажутся процессы конденсации и дегидратации. Метилгептенон оказался заметно устойчивее к воздействию анионита и даже при длительном контакте кетона с АВ-17 в конденсате не обнаружено продуктов его уплотнения. [20]
Как показали работы фирмы СНАМ, в растворе аммиака реакцию этинилирования катализируют все щелочные и щелочноземельные металлы, эффективность которых возрастает с уменьшением их электроотрицательности. [21]
Таким образом, в результате проведенных исследований была получена модель реакции этинилирования кетонов, которая адекватно отражает экспериментальные данные в широком диапазоне температур и составов исходной смеси. [22]
Практическое применение обобщенного последовательного метода отношения вероятностей для определения наиболее вероятного механизма реакции этинилирования ацетона в среде жидкого аммиака для условий дискриминирующих экспериментов показало, что в целом он приводит к тем же конечным результатам, как и энтропийный метод Бокса-Хилла. Причем по методу Бокса-Хилла оказалось достаточным поставить шесть контрольных опытов, чтобы модель 6 ( механизм Тедеши) прошла испытания. В то же время по обобщенному методу отношения вероятностей модель 6 прошла испытания после четырех контрольных опытов. Такая ситуация на практике встречается достаточно часто, так как обобщенный метод отношения вероятностей использует в процедуре принятия решений всю имеющуюся экспериментальную информацию, в том числе и результаты стартовых опытов. Последнее позволяет делать достаточно надежные выводы о наилучшей математической модели. [23]
В трудах Фаворского и его учеников получила дальнейшее развитие открытая Нефом реакция образования ацетиленовых спиртов ( реакция этинилирования) [ 203, стр. [24]
Рассмотрим кратко имеющиеся данные о механизме реакций другого типа, относящихся также к группе А - реакций этинилирования. [25]
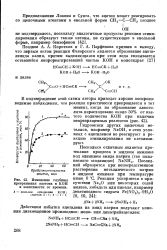 |
Изменение глубины ниже - С Реакция ускоряется в при-превращения ацетона и КОН сутствии Na20 или некоторых солей. [26] |
Гидроокиси других щелочных металлов, например NaOH, в этих условиях с ацетиленом не реагируют и реакцию этинилирования не катализируют. [27]
Метилгептенон смешивае ся с жидким аммиаком в любых отношениях, однако по сравнению с ацетоном вступает в реакцию этинилирования с меньшей скоростью. [28]
Хотя этот факт и не является неожиданным, он свидетельствует о наличии сложных взаимодействий между катализатором и компонентами реакции этинилирования и, в первую очередь, о неравнодоступности активных групп. Действительно, снижение начальной скорости этинилирования кетонов при переходе от ацетона к его гомологам наблюдается и при гомогенном этинилировании, однако в этих условиях диэтилкетон, например, реагирует в - 2 раза быстрее, чем метил-пропилкетон, тогда как в присутствии АВ-17 наоборот, метилпро-пилкетон оказался активнее диэтилкетона в - 1 5 раза. Замещенные в а - или ( З - положении кетоны оказались менее реакционно-способными по сравнению с кетонами нормального строения, наличие заместителей у у-углеродного атома практически не сказывается на относительной активности карбонильного соединения. [29]
В связи с изложенными данными становится понятной каталитическая активность металлов конца переходных серий ( I и II побочные подгруппы) в реакциях этинилирования. [30]
Страницы: 1 2 3 4