Другая электродная реакция
Cтраница 1
Другие электродные реакции - восстановление ионов Н и окисление ионов ОН или СГ - возможны только при значительно более высокой поляризации электродов. Если известны равновесные потенциалы для всех видов ионов, присутствующих в растворе, и ход соответствующих поляризационных кривых, то всегда можно предвидеть, каковы будут продукты электролиза при данных значениях А ( рк и Афа. [1]
В последнем случае в отсутствие других электродных реакций скорость растворения металла точно эквивалентна плотности пропущенного анодного тока. [2]
Если имеется возможность к протеканию еще и других электродных реакций, что, например, достигается прибавлением иода, то электрод становится обратимым и для этих реакций, и тогда в состоянии равновесия скачок потенциала иод / ионы иода должен быть равен обоим предыдущим. [3]
Кроме безбарьерного разряда ионов водорода, существуют и другие электродные реакции, следующие закономерностям безбарьерных процессов. [4]
Вместо растворения и осаждения металлов в твердофазных интеграторах можно использовать другие электродные реакции, связанные с твердофазными превращениями оксидов или солей. [5]
Поляризация при электрохимическом выделении металлов, так же как и при других электродных реакциях, зависит от плотности тока, увеличиваясь вместе с ней. Однако в данном случае характер этой зависимости часто оказывается более сложным. [6]
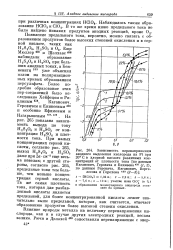 |
Зависимость перенапряжения анодного выделения кислорода на Pt при. [7] |
Влияние природы металла на величину перенапряжения кислорода, как и в случае других электродных реакций, весьма велико. [8]
Величина перенапряжения при электрохимическом выделении металлов так же, как и при других электродных реакциях, зависит от плотности тока, увеличиваясь вместе с ней. Однако в данном случае характер этой зависимости часто оказывается более сложным. [9]
Величина поляризации при электрохимическом выделении металлов так же, как и при других электродных реакциях, зависит от плотности тока, увеличиваясь вместе с ней. Однако в данном случае характер этой зависимости часто оказывается более сложным. [10]
Величина поляризации при электрохимическом выделении металлов, так же как и при других электродных реакциях, зависит от плотности тока, увеличиваясь вместе с ней. [11]
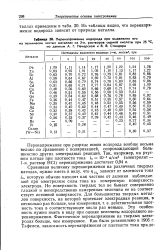 |
Перенапряжение водорода при выделении его. [12] |
Перенапряжение при разряде ионов водорода вообще весьма велико по сравнению с поляризацией, сопровождающей большинство других электродных реакций. [13]
Иногда необходимо вычислить электродный потенциал полуэлемента, реакцию которого можно представить как сочетание двух или более других электродных реакций. [14]
Иногда необходимо вычислить электродный потенциал полуэлемента, реакцию которого можно вывести путем сочетания двух или более других электродных реакций. [15]
Страницы: 1 2 3 4