Другая электродная реакция
Cтраница 4
В этих условиях с выходом 70 % были получены стабильные 1 4-диоксиацетоксинафта-лины, строение которых доказано методами ПМР и масс-спектро-метрии. Этот способ пригоден не только для электросинтеза наф-тохинонов, но и для улавливания неустойчивых продуктов анионной природы в других электродных реакциях. Однако добавка уксусного ангидрида влияет на механизм электродной реакции, так как на ртутном капельном электроде наблюдается одна двух-электронная волна хинонов вместо двух одноэлектронных. [46]
 |
Кривые титрования ферроцианида. [47] |
Это титрование прекрасно удается методом обычного амперометрического титрования, при титровании же с двумя индикаторными электродами при напряжении меньше 0 5 в оно вообще не пойдет, так как ионы цинка не восстанавливаются на платиновом электроде, а ионы ферроцианида, которые появятся в растворе после конечной точки, не имея катодной пары, тоже не будут способствовать появлению тока в цепи. Второй способ предпочтительнее, так как при малом напряжении, как уже говорилось выше, практически устраняется возможность протекания других электродных реакций. [48]
Чем больше ток, тем меньше поверхностная концентрация ионов меди и тем меньше величина ( acu) s a значит тем больше и соответствующая поляризация. Когда ( acu) s на поверхности электрода приближается к нулю, концентрационная поляризация стремится к бесконечности. Плотность тока, при которой значение ( acu) s близко к нулю, называется предельной плотностью тока. Очевидно, на практике поляризация никогда не может достичь бесконечности, так как при потенциале более высоком, чем соответствующий первой реакции, будет протекать другая электродная реакция. В случае осаждения меди, например, смещение потенциала ведет к разряду ионов водорода 2Н - Н2 - 2е, причем газообразный водород выделяется одновременно с осаждением меди. [49]
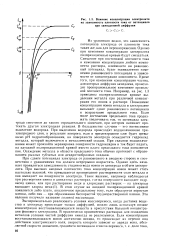 |
Влияние концентрации электролита на зависимость плотности тока от потенциала С. при замедленной диффузии. [50] |
Из уравнения видно, что зависимость потенциала электрода от плотности тока такая же, как для перенапряжения. Смещение при постоянной плотности тока и изменении концентрации любого компонента раствора, влияющего на равновесный потенциал, будет эквивалентно изменению равновесного потенциала в зависимости от концентрации компонента. Кроме того, при изменении концентрации частиц, для которых диффузия замедлена, происходит пропорциональное изменение предельной плотности тока. Например, на рис. 1.3 приведены поляризационные кривые выделения металла при различной концентрации его ионов в растворе. Повышение концентрации ионов металла в электролите вызывает сдвиг равновесного потенциала и возрастание предельного тока. Если после достижения предельного тока продолжать увеличивать ток, то потенциал электрода сместится до такого отрицательного значения, при котором начинает протекать другая электродная реакция. [51]
Все эти методы называются потенциостатическими. Электрод с постоянной поверхностью, помещенный в неперемешиваемый раствор, можно поляризовать также постоянным током. Это так называемый гальваностатический или хронопотен-циометрический метод, в котором регистрируется изменение электродного потенциала во времени. При электролизе с постоянной плотностью тока-на поверхности электрода устанавливается постоянный концентрационный градиент электроактивного вещества. Вещество, реагирующее на электроде, постепенно вытягивается из слоя раствора, непосредственно прилегающего к электроду. Таким образом, концентрация реагирующего вещества на поверхности электрода уменьшается. Когда она достигает нуля, данная-электродная реакция больше не может обеспечить достаточное количество вещества для поддержания установленной плотности тока. Электродный потенциал начинает смещаться, пока не достигнет значения, при котором протекает какая-либо другая электродная реакция. [52]
Страницы: 1 2 3 4