Другая электродная реакция
Cтраница 2
Как правило, с изменением направления тока вместо процесса, обратного первому, предпочтительно осуществляется какая-либо другая электродная реакция. [16]
Реакция катодного восстановления водорода протекает на некоторых металлах со значительным перенапряжением, существенно превышающим перенапряжение многих других электродных реакций. Значение водородного перенапряжения зависит от многих факторов и, в первую очередь, от состава раствора, материала катода и состояния его поверхности, плотности тока и температуры. [17]
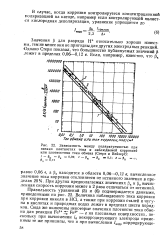 |
Зависимость между поляризуемостью при низких плотностях тока и наблюдаемой коррозией или плотностями тока обмена ( Стерн и Вейзерт. [18] |
Значения р для разряда Н относительно хорошо известны, тем не менее они не пригодны для других электродных реакций. [19]
Необходимым условием электрохимической коррозии является совмещение на поверхности корродирующего металла реакций ионизации и разряда его ионов с какой-либо другой электродной реакцией, протекающей преимущественно в катодном направлении. [20]
 |
Схема установления компромиссного ( или стационарного коррозионного потенциала 8С, когда ток обмена металла меньше тока обмена водорода. [21] |
Необходимым условием электрохимической коррозии является совмещение на поверхности корродирующего металла реакций ионизации и разряда, его ионов с какой-либо другой электродной реакцией, протекающей преимущественно в катодном направлении. В водных средах, не содержащих иных окислителей, кроме ионов водорода и растворенного кислорода, это условие выполняется в том случае, если равновесный потенциал металла отрицательнее равновесного потенциала водородного или кислородного электродов в растворе данного состава. [22]
В основе теории параллельных реакций лежит принцип независимого их протекания, согласно которому каждая нз параллельных реакций протекает независимо от всех других электродных реакций, идущих на том же электроде. Из этого принципа следует, что при заданном потенциале и прочих равных условиях скорость какой-нибудь реакции, протекающей одновременно с другими, равна скорости этой же реакции в отсутствие параллельных реакций. Для количественного рассмотрения вопроса введем допущение о том, что электрод под током имеет во всех точках один и тот же потенциал и, следовательно, ток распределяется по всей поверхности равномерно. Поскольку направленное протекание процесса возможно только тогда, когда потенциал под током лежит отрицательнее равновесного потенциала электродной реакции для катодного процесса и положительнее - для анодного процесса, то в случае параллельных реакций это же условие должно соблюдаться для всех реакций. [23]
Предельная плотность тока определяет максимальную плотность тока для данной электродной реакции, и любое его дальнейшее увеличение может быть достигнуто только за счет другой электродной реакции. Так как в водных растворах всегда присутствуют ионы водорода и воды, то выделение водорода будет сопровождаться осаждением металла при значениях плотности тока, превышающих гпр для последней реакции. Из этого следует, что для обеспечения высокой плотности тока и высокого КПД катода в гальванической ванне должны содержаться в значительной концентрации ионы металла ( гидрати-рованные катионы или анионы), вовлекаемые в процесс осаждения металла. [24]
В этом отношении особый интерес представляет реакция катодного восстановления водорода, протекающая на поверхности некоторых металлов с очень большим перенапряжением, значительно превосходящим перенапряжение многих других электродных реакций. Так, например, на ртутном катоде в 1 н, растворе соляной кислоты, при плотности тока IK 10 - 4 а / см2, потенциал сдвигается примерно на 0 9 в от равновесного потенциала водорода в этом растворе. [25]
В этом отношении особый интерес представляет реакция катодного восстановления водорода, протекающая на поверхности некоторых металлов с очень большим перенапряжением, значительно превосходящим перенапряжение многих других электродных реакций. [26]
Это заставляет предположить, что напряжение данного элемента состоит как бы из двух частей, одна из которых определяется одной электродной реакцией, а вторая - другой электродной реакцией. Химики называют эти две части электродными потенциалами, подчеркивая этим связь между напряжением и потенциальной энергией. [27]
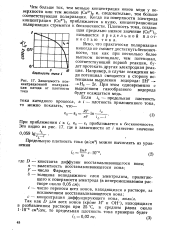 |
Зависимость концентрационной поляризации катода от плотности тока. [28] |
Ясно, что практически поляризация никогда не сможет достигнуть бесконечности, так как при несколько более высоком потенциале, чем потенциал, соответствующий первой реакции, будет протекать другая электродная реакция. [29]
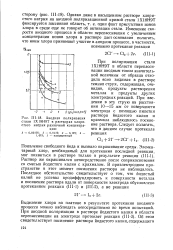 |
Анодная поляризация стали 1Х18Н9Т в растворах хлористого натрия различной концентрации. [30] |
Страницы: 1 2 3 4