Термическая реакция - углеводород
Cтраница 2
Термические реакции углеводородов протекают, главным образом, по радикально-цепному механизму. [16]
Термические реакции углеводородов протекают главным образом по радикально-цепному механизму. [17]
Поскольку углеводороды, содержащие циклопентановые кольца, не могут превращаться в ароматические углеводороды, они дегидрируются труднее, чем циклогексаны. Основная термическая реакция циклопентано-вых углеводородов состоит в их расщеплении на два олефина. [18]
Образование водородных связей существенно влияет на кинетику цепных реакций окисления углеводородов в жидкой фазе. Для термических реакций углеводородов и нефтепродуктов образование водородных связей значения, разумеется, не имеет. Влияние на кинетику термических реакций может оказывать образование я-комплексов радикалов с ароматическими углеводородами. [19]
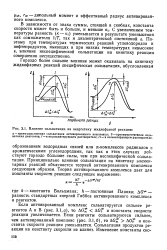 |
Влияние сольватации на энергетику жидкофазной реакции. [20] |
В зависимости от знака суммы, стоящей в скобках, константа скорости может быть и больше, и меньше к. Поэтому при температурах термических реакций углеводородов и нефтепродуктов, имеющих и при низких температурах невысокие е, влияние неспецифической сольватации на кинетику реакции совершенно несущественно. [21]
Способность ароматических и нафтено-ароматических углеводородов превращаться в глубококондснсированиые продукты приводит к тому, что эти углеводороды становятся основным источником коксообразования при термическом крекинге и пиролизе. Кокс, получаемый при термических реакциях углеводородов, язляется последней стадией конденсации веществ, содержащих в молекуле ароматические кольца. Поэтому образование кокса при пиролизе неароматического сырья вызвано образованием ароматических углеводородов, что является промежуточной стадией реакции. [22]
Поэтому проведение реакций в жидкой фазе относительно соотношения скоростей моно - и бимолекулярных реакций равносильно проведению их в газе под высоким давлением. В результате при равных температурах жид - - кофазные термические реакции углеводородов и нефтепродуктов дают много большие выходы продуктов конденсации и меньшие - продуктов распада; средняя молекулярная масса продуктов распада при этом значительно выше, чем при газофазной реакции. [23]
Бертло ( 1866 г.) при термических превращениях любого углеводорода обязательным промежуточным продуктом является ацетилен, полимеризация которого приводит к образованию разнообразных сложных углеводородов. Однако вскоре было установлено, что ацетилен не обязательный промежуточный продукт термических реакций углеводородов. [24]
На термические реакции углеводородов в значительной мере влияет присутствие в реакционной зоне некоторых каталитически действующих веществ. Катализаторы способствуют быстрому достижению состояния равновесия при любой температуре, но кроме того, поскольку в термических реакциях углеводородов возможен целый ряд промежуточных стадий, может иметь место и избирательный катализ, в результате которого данным контактным материалом будет ускоряться одна определенная реакция. [25]
Цель данной главы заключается в том, чтобы показать, что практически все реакции алифатических и алициклических углеводородов лучше всего могут быть объяснены либо механизмом с участием иона карбония, либо обычным цепным свободнорадикальным механизмом. Глава но содержит детального обсуждения массы фактов, подтверждающих действие этих механизмов, и различных альтернативных схем. Вместо этого дается единая общая основа для объяснения каталитических и термических реакций углеводородов путем установления некоторых наиболее общепризнанных принципов поведения ионов карбония и свободных радикалов. Ниже будет показано, что разнообразные внешне не связанные между собой реакции ( в том числе и побочные реакции) углеводородов могут быть объяснены на основе правдоподобной, упрощенной ( но не слишком) теории. [26]
До тех пор пока реакции такого типа не были открыты, было бы бесполезно предсказывать их поведение на основе качественных теорий. Разница между 1938 и 1964 г. состоит в том, что за это время была не только разработана теория ароматичности, но также был открыт целый ряд новых реакций благодаря развитию ГЖХ и вызванному этим интересу к термическим реакциям углеводородов. [27]
При атмосферном давлении в 1 см3 газа содержится приблизительно 1019, а в таком же объеме жидкости - примерно 1021 молекул. Поэтому проведение реакций в жидкой фазе с точки зрения соотношения скоростей моно - и бимолекулярных реакций равносильно проведению их в газовой фазе под высоким давлением. В результате при равных температурах жидкофазные термические реакции углеводородов и нефтепродуктов приводят к значительно большему выходу продуктов конденсации и меньшему выходу продуктов распада. На суммарный результат превращения углеводородов в жидкой фазе определенное влияние оказывают клеточный эффект и сольватация. При распаде молекулы углеводорода на радикалы в газовой фазе последние немедленно разлетаются. В жидкой фазе радикалы окружены клеткой из соседних молекул. Для удаления радикалов на расстояние, при котором они становятся кинетически независимыми частицами, необходимо преодолеть дополнительный активационный барьер, равный энергии активации диффузии радикала из клетки. С другой стороны, и для рекомбинации радикалы должны преодолеть клеточный эффект. [28]
При атмосферном давлении в 1 cvi3 газа содержится 1019, а в таком же объеме жидкости - примерно 1021 молекул. Поэтому проведение реакций в жидкой фазе с точки зрения соотношения скоростей моио - и бимолекулярных реакций равносильно проведению их в газовой фазе Под высоким давлением. На суммарный результат превращения углеводородов в жидкой фазе определенное влияние оказывают клеточный эффект и сольватация. При распаде молекулы углеводорода на радикалы в газовой фазе последние немедленно разлетаются. В жидкой фазе радикалы окружены клеткой из соседних молекул. Для удаления радикалов на расстояние, при котором они становятся кинетически независимыми частицами, необходимо преодолеть дополнительный активационный барьер, равный энергии активации диффузии радикала из клетки. Клеточный эффект может изменить энергию активации суммарной жидкофазной реакции относительно газофазной. Сольватация оказывает существенное влияние на скорость взаимодействия полярных частиц. Влияние сольватации на кинетику жидкофазных гемолитических реакций обычно незначительно. Скорость термических реакций углеводородов под влиянием сольватации меняется не более чем в 1 5 - 2 раза. [29]
Страницы: 1 2