Синхронная реакция
Cтраница 3
 |
Общая схема. [31] |
Если процесс состоит из нескольких одновременно происходящих независимых синхронных реакций, то каждая из них должна анализироваться отдельно. Иначе возможен случай, что наложение запрещенных и независимых процессов приведет к неверному выводу о разрешенности комбинированной реакции. Из такого рассмотрения ясно, что задача эквивалентна задаче о димеризации этилена и термический процесс запрещен по симметрии. [32]
Очень интересную проблему представляет возможность участия в синхронных реакциях циклоприсоединения таких неустойчивых соединений, как винилкарбен и его изо-электронные аналоги. Эти молекулы могут существовать в трех формах, различающихся числом л-электронов на аллильной орбитали. Первая форма ( 217) с двумя электронами в аллильной системе, как можно ожидать, комбинирует с диенами в процессе [2 4], однако преобладает независимая реакция этой молекулы как просто замещенного карбена. Вторая форма ( 218) с четырьмя электронами в аллильной системе может участвовать в нормальной синхронной комбинации с 2л - электронными молекулами, в то время как третья форма ( 219) является аналогом триплет-ного карбена. Эти системы не были изучены достаточно широко. [33]
 |
Диаграмма фотоциклоприсоединения двух идентичных молекул. [34] |
Оба доминирующих взаимодействия имеют фазовое соответствие для случая потенциально синхронной реакции. [35]
 |
Свойства симметрии орбиталей циклобутена бутадиена при конро-таторлом раскрытии иольца цвкдобутеяа или циклизации бутадиена. [36] |
Основываясь на этом, можно анализировать возможные переходные состояния синхронных реакций и делать выводы относительно их устойчивости. [37]
Согласно правилам, сформулированным Вудвордом и Гоффма-ном, направление синхронных реакций определяется симметрией граничных орбиталей. Поскольку для диенового синтеза симметрия высших занятых орбиталей продуктов реакции в основном состоянии коррелируется с симметрией орбиталей основного ( а не возбужденного) состояния исходных реагентов, то эта реакция разрешена по симметрии как термическая, что и согласуется с экспериментальным фактом. [38]
Сравнительно низкое значение Д для днмеризации циклопентадиена характерно для синхронных реакций ( см. главу 10), в которых разрыву связей сопуствует образование новых связей. Можно видеть, что оно существенно отличается от величины Д для термического разложения 1 Г - азобутана, при котором контролирующей скорость стадией является гомолитнческий разрыв связи С-N, практически без образования новых связей, которое могло бы компенсировать затраты энергии на разрыв связей, С другой стороны энтропия активации заметно благоприятствует разложению 1 1 - азо6утана за счет приобретения поступательных степеней свободы в переходном состоянии, приводящем к образованию двух частиц из одной, тогда как димеризания циклопентадиена сопровождается потерей поступательной и вращательной степеней свободы. [39]
Выше уже говорилось о том, что при этой синхронной реакции я-связи молекул этилена переходят в ст-связи молекулы циклобутана. И в этом случае только их линейные комбинации CTJ 72 хорошо описывают начинающую распадаться молекулу и удовлетворяют условиям симметрии. [40]
Рассмотрим реакцию Дильса - Альдера между молекулами бутадиена как синхронную реакцию [ л48 я28 ] - циклоприсоединения. [41]
Прежде всего нужно особенно подчеркнуть, что разрешенная по симметрии синхронная реакция не обязательно должна соответствовать истинному поведению реагирующих молекул. Вполне возможен другой путь, при котором процесс идет через образование реакционноспособных промежуточных продуктов сравнительно низкой энергии. При этом в некоторых случаях могут образовываться продукты, которые соответствуют запрещенному по симметрии синхронному процессу. В этих случаях действительный путь реакции является несинхронным, включающим дискретные промежуточные частицы. Принцип сохранения орбитальной симметрии очень полезен для определения условий, при которых следует ожидать протекания таких ступенчатых процессов. Это справедливо, например, для комбинации двух молекул этилена с образованием циклобутана. Прямая синхронная комбинация [ я28 я28 ] запрещена по симметрии, а разрешенная [ л28 л2а ] - реакция может быть реализована только в особых условиях. В таких случаях реакции протекают через бирадикальные или ионные промежуточные частицы [240] и только тогда, когда реагирующие олефины содержат заместители, которые стабилизуют необходимые промежуточные образования. [42]
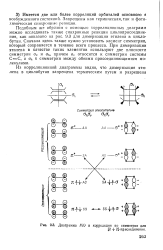 |
Диаграмма МО и корреляция по симметрии для. [43] |
Подобным же образом с помощью корреляционных диаграмм можно исследовать также синхронные реакции циклоприсоедине-ния, как показано на рис. 9.3 для димеризации этилена в цикло-бутан. Сначала здесь также нужно установить элемент симметрии, который сохраняется в течение всего процесса. При димеризации этилена в качестве таких элементов используют две плоскости симметрии а и а / j, причем о относится к симметрии системы С С, а а /, к симметрии между обеими присоединяющимися молекулами. [44]
Данные табл. 7 - 1 показывают, что характеристики заместителей благоприятствуют синхронной реакции. [45]
Страницы: 1 2 3 4