Ферментативная реакция
Cтраница 4
Скорость ферментативной реакции зависит от концентрации фермента. В известных пределах с увеличением концентрации фермента увеличивается и скорость катализируемой им реакции. Скорость же обычного неферментативного катализа практически не зависит от концентрации катализатора. При неферментативном катализе реакция достигает максимальной скорости в присутствии уже следовых количеств катализатора. [46]
Скорость ферментативных реакций падает при температурах, выше оптимальной. [47]
Кинетика ферментативных реакций как метод изучения механизма действия индивидуальных ферментов и систем ферментов все больше привлекает внимание исследователей. Использовать принципы химической кинетики применительно к реакциям, катализируемым ферментами, начали уже довольно давно - много десятилетий назад. Однако по мере того, как становилось ясно, что механизм ферментативных реакций значительно сложнее механизма самых сложных небиологических реакций, ценность измеряемых экспериментально кинетических констант подвергалась все большему сомнению. Это в свою очередь служило мощным стимулом для совершенствования теории и методов самой ферментативной кинетики. В результате эта наука сейчас достигла несомненных успехов, позволяющих достаточно плодотворно применять ее при изучении механизмов ферментативного катализа. Именно по этим причинам ни одна книга по ферментам не обходится сейчас Ч5ез глав по кинетике, хотя эти вопросы излагаются обычно достаточно кратко. [48]
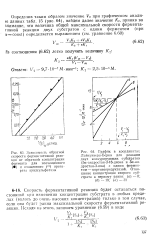
Скорость ферментативной реакции будет оставаться постоянной при изменении концентрации субстрата в любых пределах ( вплоть до очень высоких концентраций) только в том случае, если она будет равна максимальной скорости ферментативной реакции. [50]
Кинетика ферментативных реакций в предстационарном режиме их протекания изучается в основном методами остановленной струи. Принципиальная особенность этих методов состоит в быстром смешивании растворов реагирующих веществ в смесительной камере специальной конструкции [3, 4], после чего смесь поступает в измерительную кювету. Чаще всего в установках типа остановленной струи используется спектрофотометрический метод измерения с осциллографической регистрацией сигнала от фотоумножителя. Мертвое время лучших современных установок подобного типа составляет 0 1 - 0 3 мсек. [51]
Особенностью ферментативных реакций является также наличие колоколообразной зависимости скорости реакции от температуры в достаточно широком интервале, которая характеризуется температурным оптимумом реакции. Эта особенность объясняется наложением двух эффектов - возрастанием скорости реакции при увеличении температуры и ускорением тепловой денатурации белковой молекулы, приводящей к инактивации фермента при достаточно высоких температурах. При достаточно корректной постановке эксперимента оба эти явления можно изучать раздельно. [52]
Механизмы ферментативных реакций чрезвычайно сложны и еще мало изучены. Однако кинетика этих реакций часто описывается простыми уравнениями, получаемыми также из очень простых предположений. Так, кинетика инверсии тростникового сахара ( сахароза) под действием фермента сахаразы описывается в предположении образования единственного промежуточного продукта, обладающего свойствами продукта Аррениуса. [53]
Механизмы ферментативных реакций чрезвычайно сложны и еще мало изучены. Однако кинетика этих реакций часто описывается простыми уравнениями, получаемыми также из очень простых предположений. Так, кинетика инверсии тростникового сахара ( сахароза) под действием фермента сахарозы описывается в предположении образования единственного промежуточного продукта, обладающего свойствами продукта Аррениуса. [54]
Скорость ферментативных реакций обычно прямо пропорциональна концентрации фермента в первой степени. Характерно, что при заданной концентрации введенного фермента скорость реакции вначале линейно изменяется с концентрацией субстрата, а затем становится независимой от концентрации субстрата. [55]
Страницы: 1 2 3 4