Обратимая электрохимическая реакция
Cтраница 1
Обратимые электрохимические реакции отражаются в этих методах полярографическими кривыми, напоминающими по форме вторую производную. [1]
Для обратимой электрохимической реакции на РКЭ зависимость выбранных значений фарадеевского тока А /, обусловленного прямоугольным поляризующим напряжением, от потенциала развертки Е можно найти с помощью уравнения (8.91), в котором интегральный член равен нулю. Если условиться, что первый отрицательный скачок происходит при t 0 ( начало роста капли), то в уравнении (8.91) нечетные скачки Ath. [2]
Для случая обратимой электрохимической реакции, за которой следует быстрая димеризация электродных продуктов, Коутец-ким и Ганушем [704] были даны точное и приближенное решения деполяризационной задачи. [3]
Для случая обратимой электрохимической реакции, за которой следует быстрая димеризация электродных продуктов, Коутец-ким и Ганушем [704] были даны точное и приближенное решения деполяризационной задачи. [4]
 |
Эквивалентные схемы электрохимической ячейки. [5] |
При моделировании обратимых электрохимических реакций можно считать, что активационное сопротивление не вносит значимого вклада в фарадеевский импеданс. [6]
 |
Рассчитанные кривые зависимости потенциала электрода от времени при электрохимическом восстановлении при ПОСТОЯННО.. плотности тока ( / Ю-4 а / см2, с - 5 млюль / л, п 1. [7] |
В случае обратимой электрохимической реакции, как следует из уравнения ( 1 - 16а), при tlUi потенциал становится равным нормальному потенциалу обратимой окислительно-восстановительной системы, причем ни форма кривой Е - /, ни положение ее относительно оси Е не зависят от условий электролиза. [8]
Первичным продуктом обратимой электрохимической реакции является соответствующая частица, например ML или ML, отличающаяся от исходной на единицу заряда. Вероятно, Влчек [75] на примере электровосстановления ряда комплексов кобальта впервые подробно описал образование таких частиц, в которых центральный атом имеет необычную степень окисления. Тогда же было отмечено, что применение неводных растворителей, например диметилформамида, приводит к стабилизации интермедиатов на поверхности электрода. [9]
При увеличении частоты напряжения обратимые электрохимические реакции могут превратиться в квазиобратимые. [10]
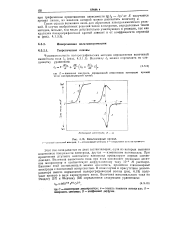 |
Вольтамперные кривые. [11] |
Такая оценка возможна лишь для обратимых электрохимических реакций. В случае необратимых реакций число электронов, определенных таким методом, меньше, чем число действительно участвующих в реакции, так как крутизна полярографической кривой зависит и от коэффициента перехода а ( разд. [12]
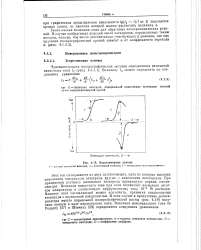 |
Вольтамперные кривые. [13] |
Такая оценка возможна лишь для обратимых электрохимических реакций. В случае необратимых реакций число электронов, определенных таким методом, меньше, чем число действительно участвующих в реакции, так как крутизна полярографической кривой зависит и от коэффициента перехода а ( разд. [14]
Нетрудно показать, что для полностью обратимых электрохимических реакций, когда k, достаточно велика ( математически, когда k - оо), уравнение Батлера-Фольмера обращается в уравнение Нернста. [15]
Страницы: 1 2 3 4