Обратимая электрохимическая реакция
Cтраница 3
Для того случая, когда сопряженная редокс-пара титранта вступает в обратимую электрохимическую реакцию, а титруемое вещество вольтам-перометрически неактивно, получают поляризационные кривые Въ Вг и В3, приведенные на рис. 4.25. До точки эквивалентности имеются окисленная и восстановленная формы титруемого соединения ( обе неактивны) и восстановленная форма титранта. Катодная реакция в этом случае состоит в выделении водорода, анодная - в окислении TrRed и разность электродных потенциалов равна A. [31]
В этом разделе рассмотрены такие процессы, при которых первичный продукт обратимой электрохимической реакции в результате химического превращения переходит в электрохимически неактивное вещество. [32]
Уже указывалось, что химическая реакция, в которую вступают продукты обратимой электрохимической реакции, вызывает смещение потенциала от величины, характерной для данной редокс-системы. Величина сдвига между Eij2 и Е тем больше, чем выше скорость реакции, в которую вступает электродный продукт, и чем больше период капания электрода, при этом по величине этого сдвига, если известен нормальный редокс-потенциал системы Е, по уравнениям, выведенным Коутецким [24] или Керном [25], может быть найдена константа скорости последующей химической реакции. [33]
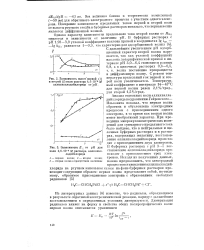 |
Зависимость Е волн 2 6 10 - 4 М раствора аллилпалладийхлорида. [34] |
Из литературных данных [6] известно, что радикалы, образующиеся в результате обратимой электрохимической реакции, наряду с дальнейшим восстановлением в определенных условиях димеризуются. [35]
Из сказанного следует, что многие особенности предволн, связанные с адсорбцией компонентов обратимой электрохимической реакции, определяются специфическими свойствами капающего ртутного электрода, поверхность которого растет во времени. Если предположить, что в некоторых случаях предволны появляются в результате замедленной адсорбции или же вызваны другими причинами, обсужденными в работах О. Мюллера [46, 47], то следует ожидать появления таких предволн и при использовании электродов с постоянной поверхностью. [36]
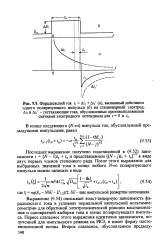 |
Фарадеевский ток / i A / i А /, ( а, вызванный действием. [37] |
Выражение (9.54) описывает вольт-амперную зависимость фа-радеевского тока в условиях нормальной импульсной вольтампе-рометрии для обратимой электрохимической реакции восстановления и однократной выборки тока в конце поляризующего импульса. Первое слагаемое этого выражения идентично зависимости, полученной для импульсного режима на РКЭ, и имеет форму посто-яннотоковой волны. [38]
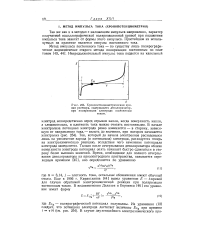 |
Хронопотенциометрическая кривая раствора, содержащего деполяризатор, при поляризации электрода постоянным. [39] |
Еще в 1906 г. Караогланов [44] вывел уравнение Е - - кривой для случая обратимой электрохимической реакции при поляризации постоянным током. [40]
Полученное выражение определяет зависимость граничных концентраций обеих форм деполяризатора от электродного потенциала в случае обратимой электрохимической реакции. [41]
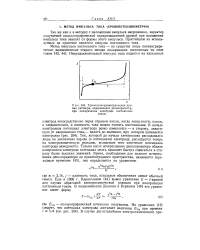 |
Хронопотенциометрическая кривая раствора, содержащего деполяризатор, при поляризации электрода постоянным током. [42] |
Еще в 1906 г. Караогланов [44] вывел уравнение Е - / - кривой для случая обратимой электрохимической реакции при поляризации постоянным током. [43]
Хронопотенциометрия с обращением направления тока ( в момент тх) позволяет определить адсорбцию на электроде продуктов обратимой электрохимической реакции. [44]
Хронопотенциометрия с обращением направления тока ( в момент TI) позволяет определить адсорбцию на электроде продуктов обратимой электрохимической реакции. [45]
Страницы: 1 2 3 4