Редокс-пара
Cтраница 1
Редокс-пара - это система из окисленной и восстановленной форм данного вещества, в которой окисленная форма ( окислитель) является акцептором электронов и восстанавливается, принимая электроны, а восстановленная форма выступает в роли донора электронов и окисляется, отдавая электроны. [1]
Следовательно, любая редокс-пара, потенциал которой при данных условиях лежит в пределах - 0 43 В Е 0 77 В, вызовет восстановление Fe до Fe2, не сопровождающееся образованием элементарного железа. [2]
Для индикации редокс-пары Н / Н2 применяют водородный электрод. Во избежание перенапряжения платинированную платиновую проволоку ( или пластину) насыщают очищенным газообразным водородом и помещают в анализируемый раствор. [3]
В качестве эталонной редокс-пары ( эталонного электрода) выбран водородный электрод: в его основе лежит обратимая полу - реакция. [4]
Стандартный ОВ потенциал редокс-пары Се4 Се3 равен Е 1 77 В при комнатной температуре. [5]
Реальный ОВ потенциал редокс-пары Sn4 Sn2 при комнатной температуре равен 0 20 В. Рассчитайте, чему равно отношение активностей окисленной и восстановленной форм o ( Sn4) / o ( Sn2) в данном растворе. Стандартный ОВ потенциал указанной редокс-пары при комнатной температуре равен Е 0 15 В. [6]
Возможность изменения потенциала определенной редокс-пары путем добавления, подходящего лиганда позволяет эффективна воздействовать на направление редокс-процессов. Поэтому этот способ нашел широкое применение в аналитической практике для предотвращения нежелательных процессов или для проведения нужных процессов, которые не идут в отсутствие соответствующих лигандов. [7]
Стандартный ОВ потенциал указанной редокс-пары при комнатной температуре равен 0 771 В. [8]
Разность потенциалов между редокс-парой А / В в стандартных условиях и стандартным водородным электродом, - который, как условно принято, обладает нулевым потенциалом, называют стандартным или нормальным водородным потенциалом редокс-пары А / В. А / В и он служит основной характеристикой окислительно-восстановительных свойств соответствующей пары. [9]
Если один из компонентов редокс-пары является неустойчивой частицей, то для наблюдения за обоими пиками подбирают соответствующую скорость изменения потенциала или время электролиза. Если электродная реакция контролируется одновременно диффузией и переносом заряда, то разность потенциалов анодного и катодного пиков A. Если скорость электрохимической стадии велика, а величина v относительно мала, то процесс обратим и & ЕР равно 58 / га мв. [10]
Чем больше окислительно-восстановительный потенциал данной редокс-пары, тем более сильным окислителем является окисленная форма этой редокс-пары. [11]
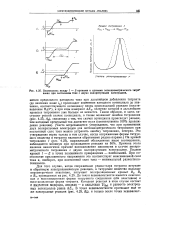 |
Взаимосвязь между / - Е - кривыми и кривыми потенциометрического титро вания при постоянном токе с двумя поляризуемыми электродами. [12] |
Для того случая, когда сопряженная редокс-пара титранта вступает в обратимую электрохимическую реакцию, а титруемое вещество вольтам-перометрически неактивно, получают поляризационные кривые Blt В2 и В3, приведенные на рис. 4.25. До точки эквивалентности имеются окисленная и восстановленная формы титруемого соединения ( обе неактивны) и восстановленная форма титранта. [13]
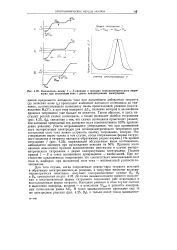 |
Взаимосвязь между / - - кривыми и кривыми потенциометрического титрош вания при постоянном токе с двумя поляризуемыми электродами. [14] |
Для того случая, когда сопряженная редокс-пара титранта вступает в обратимую электрохимическую реакцию, а титруемое вещество вольтам-перометрически неактивно, получают поляризационные кривые Въ В2 и В3, приведенные на рис. 4.25. До точки эквивалентности имеются окисленная и восстановленная формы титруемого соединения ( обе неактивны) и восстановленная форма титранта. Катодная реакция в этом случае состоит в выделении водорода, анодная - в окислении TrRed и разность электродных потенциалов равна A. [15]
Страницы: 1 2 3 4