Редокс-пара
Cтраница 2
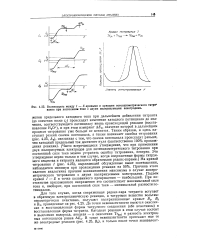 |
Взаимосвязь между / - . - кривыми и кривыми потенциометрического титро вания при постоянном токе с двумя поляризуемыми электродами. [16] |
Для того случая, когда сопряженная редокс-пара титранта вступает в обратимую электрохимическую реакцию, а титруемое вещество вольтам-перометрически неактивно, получают поляризационные кривые Въ Вг и В3, приведенные на рис. 4.25. До точки эквивалентности имеются окисленная и восстановленная формы титруемого соединения ( обе неактивны) и восстановленная форма титранта. Катодная реакция в этом случае состоит в выделении водорода, анодная - в окислении TrRed и разность электродных потенциалов равна A. [17]
Вначале рассмотрим случай, когда сопряженная редокс-пара титруемого вещества представляет собой обратимую систему и титрант является электрохимически неактивным веществом. [18]
Если один из компонентов второй редокс-пары слабо удерживает электроны и может легко отдавать их Си2, то процесс ( VI. Даниэля - в этом случае на медном электроде идет восстановление. [19]
На основании данных, полученных при вольтамперном исследовании ферри-ферроцианидной редокс-пары ( см. работу 32), выбирают потенциал индикаторного электрода, отвечающий предельному току окисления ферроцианида калия. [20]
Аналогично можно легко получить выражение для окислительно-восстановительного потенциала любой редокс-пары и тогда, когда в окислительно-восстановительной реакции участвуют ионы водорода. [21]
На основании данных, полученных при вольтамперном исследовании ферри-ферроцианидной редокс-пары ( см. работу 32), выбирают потенциал индикаторного электрода, отвечающий предельному току окисления ферроцианида калия. [22]
Этот же титрант можно использовать для определения одного из компонентов редокс-пары, второй член которой не образует с ним устойчивых комплексов. [23]
Реальный условный ( относительный) окислительно-восстановительный потенциал - это потенциал редокс-пары при условии, что участники реакции находятся в реальных условиях, а не в стандартных состояниях. Реальные потенциалы редокс-пар могут существенно отличаться от их стандартных потенциалов при той же температуре. [24]
Рассмотрим в качестве примера взаимодействие, происходящее в системе с редокс-парами: Fe2 / Fe, Zn2 / Zn и Cr2 / Cr при стандартных активностях всех участников. [25]
Такое же определение точки эквивалентности можно провести в случае, если сопряженная редокс-пара титранта ( TrRed) необратима, а титруемого вещества ( Td0x) - обратима. По мере добавления титранта образуется восстановленная форма титруемого вещества, возникает обратимая система ( ср. Из схемы В3 видно, что в точке эквивалентности ток не протекает, также и за точкой эквивалентности величина напряжения U не достаточна для протекания тока. Возникновение максимума тока на кривой титрования 2 при 50 % - ном прохождении реакции требует более подробного объяснения. [26]
Такое же определение точки эквивалентности можно провести в случае, если сопряженная редокс-пара титранта ( TrRed) необратима, а титруемого вещества ( Td0x) - обратима. Анодно-катодные кривые ( Blt 5a, B3, 54) и результирующая кривая титрования показаны на рис. 4.23. Перед началом титрования ( Si) при приложенном напряжении t / x ток не возникает. По мере добавления титранта образуется восстановленная форма титруемого вещества, возникает обратимая система ( ср. Из схемы В3 видно, что в точке эквивалентности ток не протекает, также и за точкой эквивалентности величина напряжения Ui не достаточна для протекания тока. Возникновение максимума тока на кривой титрования 2 при 50 % - ном прохождении реакции требует более подробного объяснения. [27]
Однако диффузионный потенциал необходимо учитывать яри определении концентраций окислительной или восстановительной форм соответствующей редокс-пары по измеренному значению потенциала. [28]
При каком соотношении [ Fe3 ] / IFe2 1 ] окислительно-восстановительный потенциал редокс-пары Fe / Fe2 равен стандартному потенциалу. [29]
В основе методов лежит взаимодействие определяемых катионов или анионов с ионами других реагентов с образованием соответствующей редокс-пары. [30]
Страницы: 1 2 3 4