Редокс-пара
Cтраница 3
Термодинамическим методом может быть рассчитана не только максимальная полнота окисления редоксита, но и глубина превращения редокс-пары в растворе, контактирующем с редокситом, и, в частности, глубина обескислороживания раствора. Максимально возможная исходная и равновесной концентрации следует, что медьсодержащий редоксит способен полностью обескислороживать воду. К аналогичному результату приводит расчет равновесия реакции взаимодействия кислорода с гидро-хинонным, висмутовым и другими редокситами, обладающими восстановительными свойствами. [31]
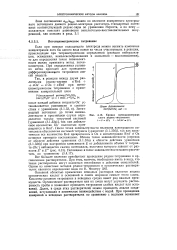 |
Кривая потенциометриче-ского редокс-титрования. [32] |
Зная соотношение a0x / aRed можно по величине измеренного электродного потенциала данного редокс-электрода рассчитать стандартный потенциал соответствующей редокс-пары по уравнению Нернста, а по нему - показатели констант равновесия окислительно-восстановительных полуреакций, как описано в разд. [33]
Зная соотношение a0x / flRed можно по величине измеренного электродного потенциала данного редокс-электрода рассчитать стандартный потенциал соответствующей редокс-пары по уравнению Нернста, а по нему - показатели констант равновесия окислительно-восстановительных полуреакций, как описано в разд. [34]
Зная соотношение flox / aRed можно по величине измеренного электродного потенциала данного редокс-электрода рассчитать стандартный потенциал соответствующей редокс-пары по уравнению Нернста, а по нему - показатели констант равновесия окислительно-восстановительных полуреакций, как описано в разд. [35]
Но тогда в этой точке в соответствии с уравнениями ( 141) и ( 142) потенциалы редокс-пары должны были бы составлять Е - оо. [36]
По уравнению Нернста можно легко вычислить, как произведение растворимости полученных в подобных случаях осадков влияет на электродный потенциал редокс-пары. Рассмотрим в качестве примера изменения, испытываемые потенциалом пары Ag / Ag, при внесении в систему хлор-ионов. [37]
При знаке минус ( -) у значения потенциала самопроизвольно протекающая реакция в исследуемом полуэлементе соответствует окислению восстановленной формы редокс-пары, при знаке плюс () - восстановлению окисленной формы. [38]
Аналогичные условия выполняются и в том случае, когда неактивный ( не способный реагировать) металл окружен раствором, содержащим редокс-пару. [39]
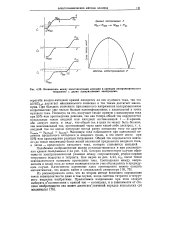 |
Взаимосвязь ме жду вольтамперными кривыми и кривыми амперометрического титрования с двумя поляризуемыми электродами. [40] |
Подобными соображениями можно руководствоваться и при рассмотрении кривой титрования 3 на рис. 4.23, которая соответствует случаю обратимости электрохимической реакции между сопряженными редокс-парами титруемого вещества и титранта. Как видно из рис. 4.23, С3, после точки эквивалентности возможно протекание тока. [41]
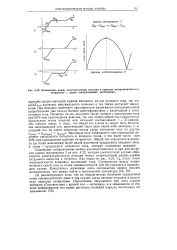 |
Взаимосвязь мфкду вольтамперными кривыми и кривыми амперометрического титрования с двумя поляризуемыми электродами. [42] |
Подобными соображениями можно руководствоваться и при рассмотрении кривой титрования 3 на рис. 4.23, которая соответствует случаю обратимости электрохимической реакции между сопряженными редокс-парами титруемого вещества и титранта. Как видно из рис. 4.23, С3) после точки эквивалентности возможно протекание тока. [43]
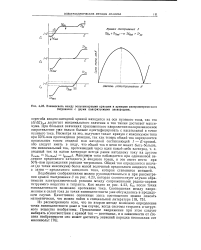 |
Взаимосвязь между вольтамперными кривыми и кривыми амперометрического титрования с двумя поляризуемыми электродами. [44] |
Подобными соображениями можно руководствоваться и при рассмотрении кривой титрования 3 на рис. 4.23, которая соответствует случаю обратимости электрохимической реакции между сопряженными редокс-парами титруемого вещества и титранта. Как видно из рис. 4.23, С3, после точки эквивалентности возможно протекание тока. [45]
Страницы: 1 2 3 4