Рендалл
Cтраница 3
Эта формула приводится Деннисоном [280]; Райт и Рендалл [956] дали формулу, лишь очень незначительно отличающуюся от этой. [31]
Полученные этими авторами результаты были использованы Льюисом и Рендаллом [4] в качестве иллюстрации плодотворности разработанного ими представления о ионной силе, а также были использованы Нойесом [5] в его анализе теории Дебая и Гюккеля. [32]
Полученные этими авторами результаты были использованы Льюисом и Рендаллом [4] в качестве иллюстрации плодотворности разработанного ими представления о ионной силе, а также были использованы Нойееом [5] в его анализе теории Дебая и Гюккепя. [33]
Результаты измерения удельных объемов этих смесей даны Льюисом и Рендаллом. Часть этих данных переведена з необходимые единицы и представлена в первых трех колонках нижеследующей таблицы. [34]
Результаты измерения удельных объемов этих смесей даны Льюисом и Рендаллом. Часть этих данных переведена в необходимые единицы и представлена в первых трех колонках нижеследующей таблицы. [35]
Понятие ионной силы было введено в 1921 г. Льюисом и Рендаллом [71], которые установили, что для разбавленных растворов коэффициент активности данного сильного электролита одинаков во всех растворах одинаковой ионной силы. Теоретические соотношения между ионной силой и коэффициентом активности были выведены Дебаем и Хюккелем [34] в 1923 г., и с тех пор многие исследователи пытаются сохранять коэффициенты активности постоянными применением растворов постоянной ионной силы. Если комплексообразование вызывает заметное изменение ионной силы ц, то предварительные значения п [37, 104] или констант устойчивости [3, 69] можно получить, используя растворы с той же самой первоначальной ионной силой, и эти значения можно использовать для расчета добавочного количества электролита, которое требуется для компенсации изменений, вызванных комплексообразова-нием. Окончательные значения констант устойчивости получают затем, используя растворы, в которых ц поддерживается постоянным. [36]
В данном уравнении принято условное обозначение, предложенное Льюисом и Рендаллом [1], согласно которому положительное значение Е соответствует уменьшению свободной энергии. [37]
Метод вычисления летучести посредством использования а впервые введен Льюисом и Рендаллом и впоследствии применялся многими другими учеными. [38]
В данном уравнении принято условное обозначение, предложенное Льюисом и Рендаллом [1], согласно которому положительное значение Е соответствует уменьшению свободной энергии. [39]
В этом интервале находятся значения частот колебаний 15 а-амидокислот, исследованных Рендаллом и др., и 10 других образцов, исследованных Фасоном и др. При образовании сложных эфиров, у которых возможность возникновения водородных связей меньше, эта частота повышается и ее значение поэтому приближается к нормальному. Май-хил и Шлеппингхоф [16] также обнаружили поглощение при частоте 3350 см 1 у ряда N-ацетиламинокислот. [40]
 |
Стандартный потенциал элемента. [41] |
Значения этих коэффициентов активности при 0 хорошо согласуются с величинами, полученными на основании данных Рендалла и Скотта о температурах замерзания. [42]
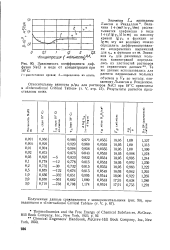 |
Зависимость коэффициента диффузии NaCl в воде от концентрации при 18 С. [43] |
Те же данные использовались для расчета парциальных мольных объемов в VB по методу, описанному Льюисом и Рендаллом. [44]
В применении к идеальным газовым смесям положение ( 22 4 12) было высказано и обосновано Льюисом и Рендаллом и называется правилом Льюиса и Рендалла. [45]
Страницы: 1 2 3 4