Термодинамическое значение
Cтраница 2
При экстраполяции результатов на нулевую ионную силу получают термодинамическое значение ионного произведения. [16]
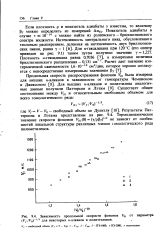 |
Зависимость продольной скорости фононов Цп от параметра ( Vf / V0 - 1 3 для некоторых н-алканов и полиэтиленов. [17] |
Результаты Пат-терсона и Лэтама представлены на рис. 9.4. Термодинамическое значение скорости фононов К ( 1) ( 0) ( у / ррт -) 1 / 2 не зависит от особенностей локальной структуры различных членов гомологического ряда полиметиленов. [18]
 |
Произведение коэффициентов. [19] |
При экстраполяции результатов на нулевую ионную силу получают термодинамическое значение ионного произведения. [20]
При измерениях окислительного потенциала колориметрическим методом для получения термодинамического значения потенциала необходимо, чтобы система приходила в равновесие с индикатором. Для этого при измерениях окислительного потенциала в системах, в которых процессы окисления - восстановления осуществляются с участием водорода и, в особенности, кислорода, так же как и при электрометрическом измерении, требуется введение катализаторов, ускоряющих окислительно-восстановительную реакцию. Кроме того, необходимо, чтобы при измерениях потенциала систем, в которых процесс восстановления осуществляется водородом, окисленная форма индикатора достаточно быстро восстанавливалась водородом. [21]
Эта точка зрения, однако, не соответствует термодинамическим значениям равновесных потенциалов МпСЬ и кислорода. [22]
Подчеркнем, что при этом речь идет о термодинамических значениях рКа, стандартизированных к разбавленным водным растворам. [23]
Следует заметить, что полная идентификация этих величин с истинно термодинамическими значениями терминов может быть опасной и зачастую вводит в заблуждение. Тем не менее в дальнейшем мы убедимся, что эти понятия весьма полезны при обработке экспериментальных данных. [24]
Уравнение (1.123), если оно справедливо, означает, что относительные термодинамические значения Ка для двух оснований могут быть определены в концентрированных растворах кислот без непосредственной оценки солевых эффектов. [25]
Насколько отличается значение, полученное методом энергий связей, от термодинамического значения. [26]
Классическая статистическая механика дает возможность подсчитать средний квадрат отклонений от термодинамических значений; в равновесном состоянии. [27]
Можно задать вопрос, является ли q теплотой активации ( аналогичной термодинамическому значению Q) или полной энергией активации ( аналогичной значению U), а также представляет ли эта величина полное содержание энергии в активированных молекулах или только избыток их энергии в сравнении со средней энергией молекул. Большее значение имеет разность между вышеупомянутыми действительной и кажущейся энергиями активации. Для реакции нулевого порядка из значения температурного коэффициента можно непосредственно вычислить q; для реакции первого порядка температурный коэффициент соответствует q - X qb, а в замедленной реакции qs q - X - - A, где последний член означает теплоту адсорбции замедляющего вещества. Когда можно отдельно измерить k и Ь, эти члены могут быть определены порознь. [28]
Таким образом, удельный удерживаемый объем выступает в качестве параметра, имеющего непосредственное термодинамическое значение. При условии, что давление пара сорбата известно, коэффициент активности может быть получен просто из измерения удерживаемых объемов. [29]
Одной из главных причин, вызывающих отклонение стационарного потенциала без тока от термодинамического значения, соответствующего 4-электронному процессу [ (1.128), ( 1.128) ], является протекание реакции ионизации кислорода только до образования перекиси водорода на всей или на части поверхности электрода. Было показано, что в случае ртути [62, 65] и малоактивного угла [61] или пирографита [67, 68] в щелочных растворах реакция ионизации кислорода до перекиси водорода в области малых поляризаций обратима. [30]
Страницы: 1 2 3 4