Взаимодействие - ион - металл
Cтраница 2
 |
Гидролиз и гидратация. [16] |
Чтобы схематически представить взаимодействие ионов металла с молекулами субстрата и ферментом в том комплексе, который образуется в процессе реакции, надо начать с чисто геометрических образов. Важность такого общего подхода отчасти оправдывается большим числом ферментов, для активации которых требуется ион металла ( около половины всех известных ферментов), отчасти обусловлена тем, что формы активирующего действия отличаются значительным разнообразием. [17]
Они образуются при взаимодействии ионов металлов с молекулами некоторых органических соединений. [18]
Эффект образования связи обусловлен взаимодействиями иона металла с растворителем и лигандом. Суммарная энергия связи определяется как стерическими, так и электронными факторами. Очевидно, что чем более объемистым является ли-ганд, тем более вероятно возникновение стерических препятствий к координации этого лиганда со стороны других лигандов, присутствующих в системе, и, следовательно, тем ниже будет энтальпия образования комплекса. [19]
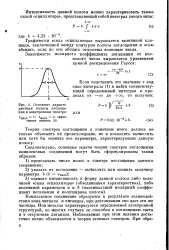 |
Основные характеристики полосы поглощения в электронном спектре. [20] |
Комплексное соединение образуется в результате взаимодействия иона металла и лигандов, при диссоциации оно дает эти же частицы. Ион металла характеризуется определенной электронной структурой, во многих случаях он способен к поглощению света и в отсутствие лигандов. Наблюдаемые при этом явления достаточно полно объясняются в теории атомных спектров. [21]
Комплексные соединения, образующиеся при взаимодействии ионов металла с электроотрицательным лигандом и органическим основанием или основным красителем, наиболее изучены и широко применяются в химической технологии и в различных методах анализа. [22]
В настоящей книге в основном рассматривается взаимодействие ионов металлов с простыми лигандами. Однако все большее значение придается исследованию взаимодействия ионов металлов с полимерными лигандами, синтетическими и натуральными, например белками. В общем случае можно говорить о двух механизмах взаимодействия противоионов с полимерными ионами [17, 18]: а) физическое взаимодействие, которое имеет в основном электростатическую природу и соответствует образованию ионных пар в мономерных системах; б) химическое взаимодействие, которое включает образование ковалентных связей, подобно образованию комплексов металл - лиганд в моноядерных системах. Неизбежно существование области перекрывания физического и химического типов взаимодействия, так называемой серой области. Она определяется природой как растворителя, так и любого из вводимых в систему ионов, поскольку структура полимера часто зависит не только от растворителя, но и от природы и количества всех ионов, присутствующих в растворе. В свою очередь конформационные изменения влияют на энергию и физического, и химического взаимодействия. [23]
Подобные же свойства характерны для продуктов взаимодействия ионов металлов с некоторыми соединениями, содержащими группы - ОН. [24]
По своей природе металлическая связь обусловлена взаимодействием ионов металла с электронами, переходящими от одного иона к другому. В этом отношении металлическая связь сближается с ковалентной связью. Однако в отличие от последней, металлическая связь не обладает ни направленностью, ни насыщенностью, сближаясь в этом отношении с ионной связью. [25]
Рассмотрим теперь вкратце энергетические соотношения при взаимодействии ионов металлов с лигандами. Такое дополнительное притяжение называется энергией стабилизации в кристаллическом поле. У иона Zn ( II) в комплексе перераспределение электронов невозможно, поскольку все d - орбитали заполнены, и по этой причине нет энергии стабилизации в кристаллическом поле. С другой стороны, у Со ( III) в октаэдрическом окружении ( случай d6) все d - электроны иона металла могут расположиться на / 2гОрбита - лях, ориентированных в направлениях между лигандами. Со ( III) имеет большую энергию стабилизации в кристаллическом поле. [26]
Для определения степени переноса заряда при взаимодействии ионов металла с ионогенными группами иони-та может быть использован потенциометрический метод. [27]
Общий подход к построению кривой титрования для реакции взаимодействия иона металла с ЭДТА существенно не отличается от использованного ранее в методах осадительного или кислотно-основного титрования. Однако в данном случае обычно необходимо рассматривать более чем одно равновесие, и поэтому вычисления становятся несколько более сложными, чем в ранее рассмотренных примерах. [28]
В основе рассматриваемого метода химической металлизации лежит реакция взаимодействия ионов металла с растворенным восстановителем, в результате которой на каталитически активную поверхность оседает слой металла. [29]
По одним представлениям, комплексные соединения получаются при взаимодействии ионов металла с молекулами воды, в результате чего образуются гидрооксикомплексы различной сложности. При этом учитывается, что при высоких температурах, характерных для растворов, выделяющихся из магмы, диэлектрическая постоянная воды намного ниже, чем при нормальных условиях, и вода перестает быть сильно ионизирующим растворителем. [30]
Страницы: 1 2 3 4