Взаимодействие - адсорбированная молекула
Cтраница 1
Взаимодействие адсорбированных молекул на поверхности раздела фаз, приводящее к их ассоциации, - явление широко распространенное. Ассоциация ионов или молекул ПАВ в присутствии воды имеет существенные особенности по сравнению с ассоциацией газов и паров. Ассоциация ПАВ обусловлена увеличением химического потенциала, выражающего тенденцию выхода компонента из водного окружения в жидкую псевдофазу. Стремление к уменьшению свободной энергии приводит к определенной ориентации ассоциированных молекул, уменьшающей разность полярностей, в результате чего ассоциат покрыт оболочкой из гидрофильных групп и имеет определенный конечный фактор ассоциации. [1]
Взаимодействие адсорбированных молекул с поверхностью может происходить под действием сил различной природы. [2]
Взаимодействие адсорбированных молекул, способных быть донорами или акцепторами электронов с решеткой катализатора, изменяет актив -, ность свободных участков поверхности. [3]
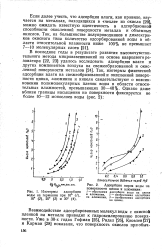 |
Изотермы адсорбции 1 - обратимая адсорбция воды на цинке. [4] |
Взаимодействие адсорбированных молекул воды с окисной пленкой на металле приводит к гидроксилированию поверхности. [5]
Силы взаимодействия адсорбированных молекул друг с другом в адсорбционном пространстве таковы же, как и силы взаимодействия между ними в свободном состоянии. Поэтому к адсорбированному газу приложимо уравнение состояния Ван-дер - Ваальса. Адсорбированное вещество будет иметь ту плотность и то агрегатное состояние, которые соответствуют его давлению в адсорбционном объеме. [6]
Силы взаимодействия адсорбированных молекул друг с другом в адсорбционном пространстве таковы же, как и силы взаимодействия между ними в свободном состоянии. Поэтому к адсорбированному газу пршюжимо уравнение состояния Ван-дер - Ваальса. Адсорбированное вещество будет иметь ту плотность и то агрегатное состояние, которые соответствуют его давлению в адсорбционном объеме. [7]
При взаимодействии адсорбированных молекул с более кислыми, чем на поверхности силикагеля, ОН-группами форма потенциальных кривых искажается сильнее. [8]
Упоминавшееся выше взаимодействие адсорбированных молекул долгое время считалось причиной понижения теплоты адсорбции с увеличением степени покрытия поверхности. [9]
Константа скорости взаимодействия адсорбированной молекулы с избыточными электронами в зоне проводимости, образованными при облучении, по-видимому, довольно близка к соответствующей константе для термических электронов. [10]
При малых заполнениях взаимодействие адсорбированных молекул воды между собой мало и по величине второго момента можно определить межпротонное расстояние в молекулах воды, которое оказалось равным 1.59 0.015 А. [11]
Аналогично, через взаимодействие адсорбированных молекул газообразного продукта реакции с адсорбционными центрами поверхности учитываются автокаталитические свойства гетерогенной химической реакции. [12]
Фрумкин [261] впервые учел взаимодействие адсорбированных молекул при выводе уравнений, связывающих поверхностное натяжение ( которое, как известно, зависит от количества адсорбированного на границе раздела фаз поверхностно-активного вещества) с концентрацией вещества в растворе, введя по аналогии с уравнением Ван-дер - Ваальса так называемый аттракционный фактор. [13]
Специальное исследование показало, что взаимодействие адсорбированных молекул водорода и кислорода связано с протеканием химической реакции. [14]
Химическая реакция происходит за счет взаимодействия адсорбированной молекулы со смежным свободным активным центром или другой адсорбированной молекулой. [15]
Страницы: 1 2 3 4