Взаимодействие - адсорбированная молекула
Cтраница 2
Эверетт полагает, что энергия взаимодействия адсорбированной молекулы с молекулами жидкой фазы равна энергии взаимодействия такой же молекулы с молекулами жидкости на поверхности раздела жидкость - пар, а энергия взаимодействия молекулы с атомами твердого тела поверхности равна энергии взаимодействия такой же молекулы, адсорбированной из пара. [16]
В своих рассуждениях Лэнгмюр не учитывал взаимодействия адсорбированных молекул друг с другом и считал коэффициенты адсорбции и десорбции постоянными. В действительности, вследствие наличия взаимодействия адсорбат-адсорбат, эти величины зависят от поверхностной концентрации поверхностно-активного вещества. Однако для целей данного изложения достаточно принять постулат Лэнгмюра и считать величины аир постоянными, как это часто делается в литературе. [17]
Важной характеристикой, отражающей количественную сторону взаимодействия адсорбированных молекул с поверхностью адсорбента, является константа Генри. [18]
При повышении температуры происходит качественное изменение во взаимодействии адсорбированных молекул с поверхностью полупроводника и между собой, что приводит к изменению положения уровня химического потенциала, а следовательно, к резкому изменению заполнения поверхностных уровней и работы выхода. [19]
Наконец, третий член отражает зависящее от Г взаимодействие адсорбированных молекул друг с другом и с адсорбентом. [20]
Значительно меньше данных имеется в настоящее время относительно взаимодействия адсорбированных молекул со структурными ОН-группа-ми других адсорбентов. В работах [26-28, 32, 33] было показано, что гид-роксилы поверхности алюмосиликатного и кремнециркониевого катализаторов не отличаются по своим свойствам от гидроксилов окиси кремния. [21]
Они предположили, что наиболее медленным этапом является взаимодействие адсорбированных молекул двуокиси серы с атомами кислорода. [22]
 |
Схема полимолекулярной адсорбции, принятая по тео. [23] |
Оба эти допущения соответствуют ленгмюровской адсорбции на однородной поверхности без взаимодействия адсорбированных молекул. [24]
Рассмотрим адсорбцию на однородной поверхности и будем учитывать при этом энергию взаимодействия адсорбированных молекул. Другими словами, сохраним первые два положения лангмюровской картины и откажемся от третьего. Очевидно, что в этом случае теплота адсорбции будет включать взаимодействие не только молекулы адсорбата с адсорбентом, но и адсорбированных молекул. [25]
Рассмотрим адсорбцию на однородной поверхности и будем учитывать при этом энергию взаимодействия адсорбированных молекул. Другими словами, сохраним первые два положения лангмюровской картины и откажемся от третьего. Очевидно, что в этом случае теплота адсорбции будет включать взаимодействие не только молекулы ад-сорбата с адсорбентом, но и адсорбированных молекул. [26]
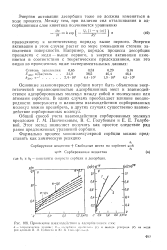 |
Проявление взаимодействия в адсорбционном слое. [27] |
Основные закономерности сорбции могут быть объяснены энергетической неравноценностью адсорбционных мест и взаимодействием адсорбированных молекул между собой и молекулами или атомами сорбента. В одних случаях преобладает влияние неоднородности поверхности и влиянием взаимодействия сорбированных молекул можно пренебречь, в других случаях существенно взаимодействие сорбированных молекул. [28]
На основании этих данных можно сделать вывод, что для большинства алифатических соединений взаимодействие адсорбированных молекул носит гидрофобный характер. При этом энер - Ьш гидрофобного взаимодействия молекул в поверхностном слое определяется природой функциональной группы и практически не зависит от длины углеводородного радикала. [29]
При любом рассмотрении структуры адсорбционного слоя при полном заполнении поверхности адсорбента необходимо учитывать взаимодействие адсорбированных молекул друг с другом, которое также будет влиять на конформаций молекулярных цепей в адсорбционном слое. Практически такое рассмотрение до сих пор не проводилось, хотя имеются указания на необходимость его учета. [30]
Страницы: 1 2 3 4