Дативное взаимодействие
Cтраница 1
Дативное взаимодействие d - ка-тионов с л - разрыхляющими орбиталями лиганда создает условия для высокой кинетической и термодинамической устойчивости комплексов этих лигандов. [1]
 |
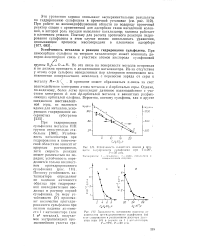
Примеры проявления различной ковалентности атомами углерода, азота и кислорода.| Электронное строение атомов фосфора ( а и серы ( б. [2] |
Как видно, дативное взаимодействие сопряжено с донорно-акцеп-торным, в более общем случае - с образованием ковалентной связи. Главное их отличие в том, что донорно-акцепторное взаимодействие приводит к образованию cr - связи, а дативное - л-связи. Неподеленные пары электронов атомов азота и кислорода способны перекрываться с вакантными Зс. ОН и NH2 понижается, а подвижность протонов возрастает. [3]
 |
Примеры проявления различной ковалентности атомами углерода, азота и кислорода.| Электронное строение атомов фосфора ( а и серы ( б. [4] |
Как видно, дативное взаимодействие сопряжено с донорно-акцеп-торным, в более общем случае - с образованием ковалентной связи. Главное их отличие в том, что донорно-акцепторное взаимодействие приводит к образованию а-связи, а дативное - л-связи. Неподеленные пары электронов атомов азота и кислорода способны перекрываться с вакантными Sd-орбита-лями атома кремния, вследствие чего основность групп ОН и NH2 понижается, а подвижность протонов возрастает. [5]
Межмолекулярная координация таких соединений обусловлена дативным взаимодействием атомов кислорода с гетероатомами. Прочность аутокомплексов гетероси-локсанов колеблется в широких пределах. В ряде случаев ком-плексообразование подобного типа отчетливо не проявляется и обнаруживается лишь по некоторому возрастанию молекулярного веса. При ассоциации молекул гетеросилоксанов решающее значение имеют природа гетероатома и его валентное состояние. [6]
Все имеющиеся факты показывают, что дативное взаимодействие играет очень важную роль при активации ацетилена в жидкофазных каталитических синтезах. [7]
Однако, по-видимому, более легко происходит дативное взаимодействие с участием электронов d - или rf / 7-орбиталей металла и вакантных разрыхляющих орбиталей олефина. [9]
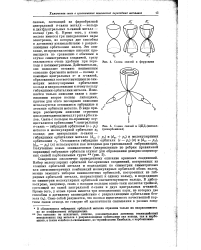 |
Схема связей в ферроцене.| Схема связей в ЦПД - ( металл-трикарбонилах. [10] |
Это описание не исключает, конечно, дополнительных дативных взаимодействий неподеленных пар металла с разрыхляющими орбиталями как кольца, так я карбо-нилов, а также слабого я-связывания, по терминологии Кимбалла, с карбонилами. [11]
Рис, 27 10, Схема, иллюстрирующая дативное взаимодействие между заполненной - орбиталью металла и свободной Sd-орбиталью фосфора в лигандах типа РХЯ; за ось z принята линия, соединяющая атомы металла и фосфора. Такое же перекрывание с участием 2-орбиталей происходит в плоскости иг. [12]
При акцептировании ими электронов центрального атома становится возможным дативное взаимодействие, степень которого зависит от - индивидуальных свойств донора и от электроотрицательности связанных с ним групп. [13]
Окраска соединений элементов с насыщенной Й1 0-орбиталью определяется дативным взаимодействием металл - литанд. Все соединения элементов в степени окисления 2, 3 обладают основными свойствами, в степени окисления 4 - амфотерны, в более высоких степенях окисления имеют кислотный характер. Растворимые в воде соли переходных элементов подвергаются значительному гидролизу. [14]
Если предположить, что реакционным центром является Вг, то дативное взаимодействие с платиной должно благоприятствовать реакции олефина при стабилизации промежуточного иона карбония. [15]
Страницы: 1 2 3 4