Дативное взаимодействие
Cтраница 2
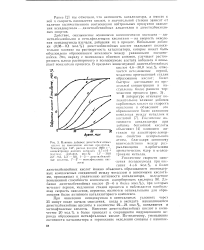
Последняя в частности, способна к а-донорному и я - акцепторному дативному взаимодействию и может выступать в качестве лиганда в комплексных соединениях. Большой теоретический и практический интерес представляют соединения, в которых роль лиганда играют молекулы азота. [16]
Последняя в частности, способна к сг-донорному и л - акцепторному дативному взаимодействию и может выступать в качестве лиганда в комплексных соединениях. Большой теоретический и практический интерес представляют соединения, в которых роль лиганда играют молекулы азота. [17]
Применение метода возможно лишь после удаления соединений кислого характера, которые из-за дативных взаимодействий выделяются вместе с азотистыми соединениями. [18]
Этого можно было ожидать, так как при увеличении основности возрастает способность к дативному взаимодействию и связь Ni - С делается прочнее. Для этого процесса предложен диссоциативный механизм. [19]
На ионизацию электролита определенное влияние оказывает полярность молекул растворителя, их способность к донорно-акцепторному и дативному взаимодействию с растворенным веществом и ионами, способность молекул растворителя образовать водородные связи. Выделяющаяся при сольватации ионов энергия часто с избытком компенсирует энергию, необходимую для разрушения кристаллической решетки и разрыва связей в молекулах растворяемых веществ. [20]
 |
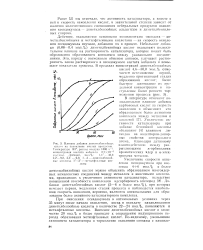
Схема молекулярных орбит комплекса. [21] |
В каталитических реакциях с участием олефинов и ацетилена наиболее активны соединения металлов, склонных к дативному взаимодействию. [22]
В этих соединениях комплексообразователь выступает и в качестве донора, и как акцептор, т.е. здесь реализуется дативное взаимодействие. [23]
Кроме того, у атома железа имеется три неподеленных пары электронов, из которых две способны к дативному взаимодействию с разрыхляющими орбита л ями колец. Это описание, не представляющее никаких преимуществ по сравнению с обычным в случае симметричных сэндвичей, сразу оказывается очень удобным при переходе к несимметричным. Действительно, оно позволяет оставить неизменным описание фрагмента металл - кольцо с помощью центральных а - и л-связей, образованных соответствующими по симметрии молекулярными орбиталями кольца и направленными к этому кольцу гибридными орбиталями металла. Изменяется только описание связи с заменившими второе кольцо лигандами, причем для этого последнего описания используются оставшиеся гибридные и атомные орбитали металла. В виде примера рассмотрим описание строения цик лопентадиенилметал л т р ик а р б о н и-лов. [24]
Увеличение активности катализатора при добавке бензойной кислоты объясняют [4] влиянием ли-гандов на акцспторио-донор-ные свойства центрального атома, благодаря дативному взаимодействию между разрыхляющими л-орбиталями ароматических ядер и ц-элск-тронами металла. [26]
Увеличение активности катализатора при добавке бензойной, кислоты объясняют [4] влиянием ли-гапдов на акцепторно-донор-ные свойства центрального атома, благодаря дативному взаимодействию между разрыхляющими я-орбиталями ароматических ядер и а-элек-тронами металла. [28]
Среди ионов металлов с конфигурацией dw каталитическая активность увеличивается сверху вниз в периодической системе в соответствии с ростом их способности к дативному взаимодействию. [29]
Как указывалось выше, подавляющее большинство комплексов Ru с NO имеют общую формулу RuNOL5; если постулировать, что электрон переходит от молекулы NO к Ru 1 с последующим дативным взаимодействием между NO и атомом металла, то рутений в таких комплексах является формально двухвалентным. Железо почти не образует подобных октаэдрических комплексов, если не считать цианидных производных. Больший радиус иона Ru3 ( - 0 72 А) по сравнению с радиусом иона Fe3 ( - 0 64 А) способствует более эффективному dn - рл-перекрьшанию, за счет которого образуется л-связь с молекулой NO. Соединения осмия с окисью азота сравнительно редки и менее устойчивы, чем их рутениевые аналоги, но в этом случае различия можно объяснить пониженной устойчивостью к окислению, характерной для комплексов двухвалентного осмия. Возможно также, что вследствие легкости, с которой окисляются Ru и Os в состоянии 1, оба металла не способны к образованию группировок с двумя молекулами NO в октаэдрических комплексах. [30]
Страницы: 1 2 3 4