Поляризационное взаимодействие
Cтраница 1
 |
Частицы карбоната. [1] |
Поляризационное взаимодействие увеличивает прочность тиксотропных структур, что, по-видимому, также должно иметь место в производственных процессах электрообработки различных дисперсных материалов и естественных дисперсных систем - почв и грунтов. [2]
Поляризационное взаимодействие обусловлено деформацией электронной оболочки одной молекулы под влиянием электрич. [4]
Увеличенным поляризационным взаимодействием объясняется, например, большая устойчивость аммиакатов переходных металлов по сравнению с их гидратами. [5]
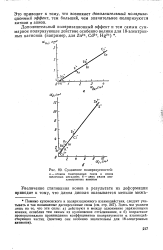
Энергия поляризационного взаимодействия существенно зависит от напряженности поля и размера частиц. Поэтому увеличение напряженности поля определяет резкое уменьшение барьера отталкивания частиц и ускорение коагуляционных процессов. При выключении поля происходит пептизация таких систем, что не всегда приемлемо с точки зрения очистки воды. [6]
Энергия поляризационного взаимодействия между молекулами примерно на порядок меньше энергии лондоновского и дипольного взаимодействия. 5& Б Т при 300 К - Тем не менее, поляризационное взаимодействие между молекулами оказывает существенное влияние на свойства полярных жидкостей. Полярная молекула поляризует всю окружающую ее массу молекул и создает ( индуцирует) в этом окружении некоторый дипольный момент Дц, величина которого зависит от поляризуемости и диэлектрической проницаемости среды. Поляризация окружающей среды создает поле ( реактивное поле) в том элементе объема, где находится полярная молекула. В результате происходит дополнительная поляризация полярной молекулы. Реакция окружающей среды на присутствие в ней полярной молекулы приводит к появлению реактивного поля, действующего на молекулу. В итоге возникает существенный дополнительный вклад в энергию взаимодействия полярных молекул со средой. Нетрудно понять, что этот вклад пропорционален числу молекул в единице объема. Он значителен в жидкой фазе и мал в разреженных парах. Влияние этого фактора будет рассмотрено в гл. [7]
 |
Сравнение поляризуемостеи. [8] |
Помимо кулоновского и поляризационного взаимодействия, следует учитывать и так называемые дисперсионные силы ( см. стр. [9]
Если бы поляризационные взаимодействия ионов отсутствовали, то тип кристаллической решетки ионного соединения должен был бы зависеть только от количественного соотношения различных частиц и их размеров. Однако поляризационные явления играют при образовании кристаллов весьма важную роль и часто сильно влияют на формирование кристаллизующимся веществом решетки того или иного типа. [10]
 |
Поляризационная энергия - ЩДА. [11] |
Преобладающая роль поляризационного взаимодействия в слабых яя - и яо-комплексах выявлена [48-50] при расчетах дипольных моментов комплексов тетрацианэтилена с нафталином, метил-бензолами, комплекса иода с бензолом. [12]
 |
Ионный потенциал и химические свойства гидроокисей.| Схема влияния силы дают постоянным диполем. Это обстоятельство позво-поля на общую поляризацию. [13] |
Различная интенсивность поляризационных взаимодействий с анионами у 8-и 18-электронных катионов близкого радиуса отчетливо выявляется на примере молекул NaCl и AgCb при почти равных ядерных расстояниях ( 2 36 и 2 28 А) их диполь-ные моменты - 9 0 у NaCl и 5 7 у AgCl - очень различны. [14]
Различная интенсивность поляризационных взаимодействий с анионами у 8 - н 18-электронных катионов близкого радиуса отчетливо выявляется на примере молекул NaCl и AgCI: при почти равных ядерных расстояниях ( 2 36 и 2 28 А) их диполь-ные моменты - 8 5 у NaCl и 5 7 у AgCI-очень различны. [15]
Страницы: 1 2 3 4
