Поляризационное взаимодействие
Cтраница 3
В приложении представлений о поляризационных взаимодействиях к явлениям комплексообразования учитывается не только поляризуемость лигандов, но и деформация электронных оболочек центральных атомов, вызывающая взаимное проникновение электронных оболочек центрального атома и лигандов. [31]
Однако после этого следует ввести поляризационные взаимодействия в переходном состоянии, возникающие в процессе активации и обусловленные электрическими свойствами реакционного центра относительно окружающей поляризуемой структуры. Такая дополнительная поляризация, которая, как впервые отметили Флоренс Шоу и автор [62], может иметь большое значение при рассмотрении скоростей реакций, является быстротечной и в отличие от поляризации не может быть исследована в основном состоянии. Ее величина может быть оценена только из электронных условий реакции и поляризуемости молекулы. По этой причине два указанных выше механизма электронных смещений в том случае, когда они действуют во время реакции и таким образом зависят от времени, называются эффектами поляризуемости. [32]
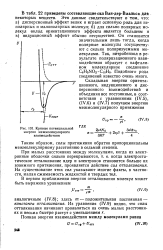 |
Кривые потенциальной. [33] |
Так, нитробензол в результате поляризационного взаимодействия образует с нафталином молекулярное соединение CeHsNOz-CioHs. Подобного рода соединений известно очень много. [34]
Формулы Капустинского не учитывают энергии поляризационного взаимодействия ионов; последнее имеет существенное значение в случае наименее прочных комплексов. Поэтому точность расчетов устойчивости комплексных соединений, основанных на применении формулы Капустинского не следует переоценивать. [35]
Например, к такого рода поляризационному взаимодействию способна окись алюминия, не дающая в то же время в обычных условиях твердых растворов с кислородом. [36]
Значение рН растворов нитратов определяется поляризационным взаимодействием катиона, а не аниона, с молекулами воды. Нитраты Bi3, Hg2 и Hgi в воде из-за сильного гидролиза растворяются незначительно. Водные суспензии этих солей имеют рН около единицы. Для подавления гидролиза и растворения солей добавляют немного концентрированной азотной кислоты. [37]
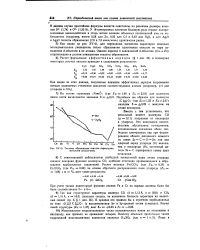 |
Теплоты образования окислов переходных металлов ( ккал / г-экв. [38] |
У 18-электронных катионов большую роль играют поляризационные взаимодействия и столь четкое влияние объемных соотношений уже не наблюдается ( например, имеем 0 58 для Zn, 0 56 для Cd и 0 63 для Hg), а для AgzS и AgsO теплоты образования ( 7 6 и 7 3 ккал / моль) практически равны. [39]
Аналогично изложенному в основном тексте сказывается поляризационное взаимодействие ионов и на решетках тернарных соединений. Усиление его благоприятствует здесь переходу структур по ряду: тип СаР2 - тип ТЮ2 - слоистые решетки - молекулярные решетки. Конечной структурой, характерной для наиболее сильного поляризационного взаимодействия ионов, является опять-таки молекулярная решетка. [40]
Аналогично изложенному в основном тексте сказывается поляризационное взаимодействие ионов и на решетках тернарных соединений. Усиление его благоприятствует здесь переходу структур по ряду: тип СаРа - тип ТЮг - слоистые решетки - молекулярные решетки. Конечной структурой, характерной для наиболее сильного поляризационного взаимодействия ионов, является опять-таки молекулярная решетка. [41]
Согласно представлениям ряда авторов, пределом поляризационного взаимодействия является образование ковалентной связи. [42]
Кроме размеров ионов и общей интенсивности поляризационного взаимодействия между ними, большое значение для выбора типа кристаллической структуры имеет, по Гольдшмидту, степень симметричности этого взаимодействия. Чем ближе друг к другу оба иона по своим поляризационным свойствам, тем более вероятным становится возникновение структур с высокими координационными числами. Наоборот, резкое различие поляризационных свойств обоих ионов благоприятствует возникновению структур с низкими координационными числами. Этой закономерностью объясняется, например, кристаллизация Т1С1, TIBr и ТП по типу CsCl ( КЧ 8), тогда как аналогичные соли рубидия кристаллизуются по типу NaCl ( К. [43]
Кроме размеров ионов и общей интенсивности поляризационного взаимодействия между ними, большое значение для выбора типа кристаллической структуры имеет по Гольдшмидту степень симметричности этого взаимодействия. Чем ближе друг к другу оба иона по своим поляризационным свойствам, тем более вероятным становится возникновение структур с высокими координационными числами. Наоборот, резкое различие поляризационных свойств обоих ионов благоприятствует возникновению структур с низкими координационными числами. [44]
И в этом случае также имеет место поляризационное взаимодействие. [45]
Страницы: 1 2 3 4