Водно-ацетоновая среда
Cтраница 4
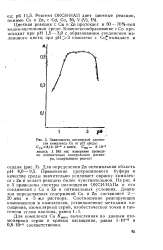 |
Зависимость оптической плотности комплекса Си от рН среды. ССи3 14 - 10 - 5 г-ион / л. CHR 8 - 10 - 5. [46] |
Цветная реакция с Си и Zn протекает в 50 - 70 % - ной водно-ацетоновой среде. [47]
При определении малых количеств молибдена в вольфрамовых и молибденовых рудах роданидную реакцию производят в водно-ацетоновой среде и для предотвращения помехи со стороны вольфрама применяют цитрат5, Железо мешает, давая слабую окраску, и поэтому его удаляют. В присутствии вольфрама фосфор, если его только не очень мало ( около 30 мг), мешает, вызывая побледнение окраски молибденово-роданидного комплекса, и раствор постепенно окрашивается в синий цвет. Большие количества ванадия сообщают раствору сине-зеленую окраску. Несколько сотых долей миллиграмма молибдена можно точно определить в присутствии 0 2 г или более трехокиси вольфрама. [48]
Хлорфосфоиазо III может быть использован как индикатор при титровапим солей пария растворами сульфатов в водно-ацетоновой среде. Переход окраски очень четкий и быстрый. [49]
К разбавленному раствору электролита добавляют Н2О2 для окисления железа и титруют гидроокисью натрия в водно-ацетоновой среде ( 1: 4); сначала нейтрализуется H2SO4 и осаждаются гидроокиси, а затем вытесняется аммиак. [50]
При добавлении к известному количеству Н3РО4 ( 0 1 - 0 5 ммоля) в водно-ацетоновой среде ( отношение вода: аце-тон 1: 7 - 1: 5, титруемый объем 50 - 70 мл) сухой соли KNO3 ( около 0 5 г) при постоянном перемешивании раствора с помощью магнитной мешалки через некоторое время наблюдается появление осадка с одновременным уменьшением величины рН раствора. [51]
Рассчитаны константы равновесия и степени превращения 2 2-диметил - 4-децил - 1 3-диоксолана в диол в водно-ацетоновой среде при различных температурах и мольном отношении реагентов. [52]
Рассчитаны константы равновесия и степени превращения 2 2-диметил - 4-дсцил - 1 3-диоксолаиа в диол в водно-ацетоновой среде при различных температурах и мольном отношении реагентов. Показано хорошее соответствие расчетных и экспериментальных данных степени превращения 2 2-димстил - 4-децил - 1 3-диоксолана в диол. [53]
Изучены кинетические закономерности и приведен механизм реакции гидролиза 2 2-диметил - 4-децил - 1 3-диоксолапа в водно-ацетоновой среде в присутствии ортофосфорной кислоты. Найдены константы скорости, эффективная энергия активации прямой и обратной реакции. Рассчитан тепловой эффект реакции. [54]
Первичные и вторичные алкилпроиз-водные дикарбонилциклопентадиепилжелеза при окислении хлоридом меди ( II) или другими окислителями в водно-ацетоновой среде образуют продукты карбоксилнрования - карбоновые кислоты, а при проведении реакции в спиртовой среде превращаются в соответствующие эфиры. [55]
Роданидный комплекс в водных растворах в значительной степени диссоциирует, а потому колориметрическое определение ведется в водно-ацетоновой среде. Ацетон сильно снижает диссоциацию комплекса. [56]
Страницы: 1 2 3 4