Электронное строение
Cтраница 2
Электронное строение бензола описывается резонансом пяти канонич. [16]
Электронное строение тт-связи б ыло рассмотрено в разд. Дополнительно следует указать на следующее. Энергия разрыва молекулы по двойной связи СС равна 146 ккал / моль; так как энергия сг-связи С - С равна 81 ккал / моль, то, следовательно, энергия разрыва п-связи равна лишь 146 - 81 65 ккал / моль. Электроны значительно легче оэлектронов поддаются влиянию, например поляризующих растворителей, или воздействию любых атакующих реагентов ( см. гл. [17]
Электронное строение кластеров [ Ме6Х3 ] 2 и [ МееХ12 ] 4 было рассмотрено недавно Коттоном и Хассом [19] на основе метода молекулярных орбиталей. [18]
Электронное строение гелия имеет конфигурацию Is2 и также эквивалентно строению атомов других благородных газов, поскольку в данном случае отсутствует lp - подуровень. Все благородные газы характеризуются высокими потенциалами ионизации ( см. табл. 6.5), так как каждый электрон на самом верхнем энергетическом уровне их атомов лишь очень слабо экранируется от воздействия ядра другими электронами, находящимися на этом же самом уровне. Каждый валентный электрон в атомах этих элементов ощущает действие довольно большого положительного заряда ядра, и для того, чтобы оторвать валентный электрон от атома, требуется большая энергия. Таким образом, обнаруживается, что электронное строение благородных газов чрезвычайно устойчиво по отношению к изменениям, связанным с потерей или присоединением электронов. [19]
Электронное строение кластеров [ Ме6Х8 ] 2 и [ МевХ12 ] 4 было рассмотрено недавно Коттоном и Хассом [19] на основе метода молекулярных орбиталей. [20]
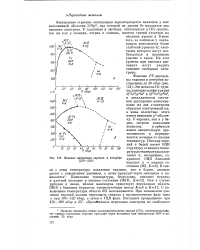 |
Фазовые диаграммы европия и иттербия. [21] |
Электронное строение лантаноидов характеризуется наличием у них заполненной оболочки 5s25pe, над которой на уровне 6s находятся два внешних электрона. [22]
Электронное строение карбокси-лат-аниона; факторы, влияющие на снижение карбонильной активности кислот по сравнению с альдегидами; важнейшие химические свойства кислот и их функциональных производных; механизм реакции взаимодействия кислот со спиртами; свойства сложных эфиров и жиров. [23]
Электронное строение алкенов иллюстрируется ниже на приме этилена. [24]
Электронное строение алканов в терминах правила октетов Льюиса и концепции гибридизации атомных орбиталей иллюстрируется на примере метана. [25]
 |
Формирование молекулярных тс-орбиталей этилена. [26] |
Электронное строение алкенов иллюстрируется ниже на примере этилена. [27]
Электронное строение альдегидов и кетонов показано ниже также на примере формальдегида. [28]
Электронное строение тс-свя-зи было рассмотрено в гл. Дополнительно следует указать на следующее. Энергия разрыва молекулы по двойной связи СС равна 611 кДж / моль; так как энергия а-связи С - С равна 339 кДж / моль, то энергия разрыва тг-связи равна лишь 611 - 339 272 кДж / моль. Электроны значительно легче а-электронов поддаются влиянию, например, поляризующих растворителей или воздействию любых атакующих реагентов ( см. гл. Это объясняется различием в симметрии распределения электронного облака а - и я-электронов. С поворотом половинок молекулы относительно друг друга по оси двойной связи степень перекрывания орбиталей снижается, что связано с затратой энергии. Следствием этого является отсутствие свободного вращения по оси двойной связи и существование геометрических изомеров при соответствующем замещении у атомов углерода ( см. далее разд. [29]
Электронное строение лантаноидов и актиноидов по элементам не приведено. [30]
Страницы: 1 2 3 4