Первичная структура - белок
Cтраница 1
Первичная структура белка определяется числом и последовательностью ковалентно связанных аминокислот. Полипептидная цепь благодаря водородным связям, образующимся между кислородными атомами карбонильных групп и азотными атомами амидных групп, приобретает вторичную структуру; она может образовать спиральную конфигурацию ( а-спираль) или конфигурацию так называемого складчатого слоя. Третичной структурой называют определенное пространственное расположение пептидной цепи, обусловленное взаимодействием между различными ее боковыми группами. В поддержании третичной структуры участвуют другие водородные связи, ионные связи и неполярные ( гидрофобные) взаимодействия. Поперечные связи, соединяющие различные участки полипептидной цепи, могут быть и ковалентными; таковы, например, дисуль-фидные связи, образующиеся при окислении SH-груцп. И наконец, благодаря взаимодействиям нескольких полипептидных цепей могут возникать надмолекулярные агрегаты. Такое строение ( при котором белок состоит из определенного числа полипептидных цепей, или субъединиц) называют четвертичной структурой. При физиологических условиях белок находится в водной фазе. Поэтому между белками и диполями воды тоже имеет место взаимодействие. Факторы, вызывающие изменение заряда белков ( концентрации ионов Н, Са2, Mg2, К и др.), неизбежно влияют также на степень гидратации, а тем самым и на степень набухания белков. [1]
Первичная структура белков устанавливается методами химической деструкции. [2]
Первичная структура белка ( разд. [3]
Первичная структура белка генетически детерминирована и воспроизводится в процессах транскрипции и трансляции. [4]
Первичная структура белка является основной для формирования последующих структур белка за счет взаимодействия радикалов аминокислотных остатков полипептидной цепи. [5]
 |
Первичная структура полипептидной цепи лизоцима ( схема. [6] |
Первичная структура белков уникальна и детерминирована генетически. Каждый индивидуальный гомогенный белок характеризуется уникальной последовательностью аминокислот: частота замены аминокислот приводит не только к структурным перестройкам, но и к изменениям физико-химических свойств и биологических функций. [7]
Первичная структура белка имеет, как уже сказано, определяющее значение для его функции. Это подтверждается прежде всего двумя группами фактов. [8]
 |
Фрагмент полипептидной цепи в форме а-спирали. [9] |
Первичная структура белков определяется их составом и может быть описана последовательностью ос-аминокислотных остатков в полипептидных цепях. Эта последовательность определяет строение белка. Для установления первичной структуры используются разнообразные методы деструкции, которые были уже рассмотрены в разделе, посвященном пептидам. Однако исследование первичной структуры белков вследствие наличия более длинных цепей является гораздо более сложным делом и связано с большими затратами времени, чем у пептидов. К примеру, миоглобин содержит одну полипептидную цепь, состоящую из 153 аминокислотных остатков, а глобин имеет четыре полииептидные цепи, две пары которых построены аналогично и содержат соответственно 141 ( а-цепи) и 146 ( р-цепи) аминокислотных остатков. В одной из патологических форм гемоглобина, возникающей при серповидной анемии и наблюдаемой прежде всего у африканцев, только один единственный аминокислотный остаток глутамина в р-цепи нормального глобина замещен на остаток валина. [10]
Первичная структура белка может быть установлена косвенно следующим образом: сначала получают соответствующую кДНК, затем идентифицируют клон, относящийся к анализируемому белку, и по чередованию в нем нукле-отидов с использованием библиотеки аминокислотных последовательностей определяют первичную структуру белка. [11]
Первичная структура белков устанавливается методами химической деструкции, в основном методом ступенчатого гидролиза или ферментативной деструкции с помощью различных протеаз. Используя набор различных протеаз, селективно гидролизующих связи между конкретными аминокислотами, изменяя условия ферментативного и химического гидролиза ( время, температуру и рН), можно получать различные осколки, на основании которых создается представление об исходной белковой молекуле. [12]
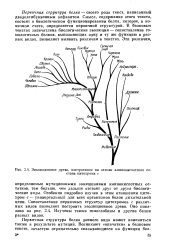 |
Эволюционное древо, построенное на основе аминокислотного состава цитохроыа с. [13] |
Первичная структура белка данного вида может изменяться также в результате мутаций. [14]
Первичной структурой белков называют последовательность аминокислотных остатков в полипептидной цепи. Пептидная связь, характерная для первичной структуры, не является полностью одинарной. По некоторым данным, пептидная связь является частично двойной и частично одинарной. Обе структуры динамичны, и между ними имеются взаимные переходы. [15]
Страницы: 1 2 3 4