Вторичная структура - белок
Cтраница 3
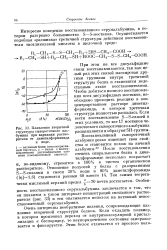 |
Плавление вторичной ловеческого сывороточного альбумина. [31] |
Очень интересны необратимые явления, сопровождающие плавление вторичной структуры белков. Если охладить полимер, в котором произошел переход от внутримолекулярной кристаллизации к беспорядку, то неупорядоченное состояние замораживается и фиксируется. [32]
 |
Модель третичной структуры. [33] |
Спиральная и нитевидная р-формы полипептидных цепей являются вторичной структурой белка. [34]
Водородные связи играют решающую роль в определении типа вторичной структуры белков. В миоглобине методами рент-геноструктурного анализа были обнаружены водородные связи, участвующие также и в стабилизации третичной структуры мод. [35]
 |
Структура Р - ке-ратина.| Сложная спираль белка, состоящая из семи спиралей.| Модель строения миоглобина. [36] |
Еще несколько лет назад полагали, что а-спирали вторичных структур белка соединяются бок о бок, одна рядом с другой - субъединица белка здесь представляет собой пласт полипептидных спиралей, а не кабель или пучок. Пласты обращены друг к другу своими гидрофобными либо гидрофильными частями. [37]
 |
Формы нормальных колебаний амидной группы в N-метилаодта-миде ( М - метильная группа. [38] |
Таким образом, ИК-спектры могут быть применены для определения вторичной структуры белка, для изучения ионизации аминокислотных остатков и, что особенно важно, для изучения кинетики дейтерообмена. [39]
Пептидная цепь имеет определенную пространственную форму, которая составляет вторичную структуру белка. В природных белках пептидная цепь имеет форму спирали, обычно ее называют ос-спиралью. [40]
Именно такие водородные связи в первую очередь считаются ответственными за формирование вторичной структуры белков. [41]
Была проверена применимость изложенного выше метода расчета вклада различных конформаций во вторичную структуру белка на таком хорошо изученном белке, как лизоцим. Использовались значения параметров а0 и 60 для лизоцима, рассчитанные из уравнения Мофитта - Янга на основании экспериментальных данных, полученных для водных растворов лизоцима и его растворов в 8 М водном растворе мочевины. [42]
Пространственная конфигурация полипептидной цепи, точнее тип полипептидной спирали, определяет вторичную структуру белка. Она представлена в основном а-спиралью, которая фиксирована водородными связями ( стр. [43]
В работах О. Б. Птицыяа [ 52J и ряда других авторов предложен метод предсказания вторичной структуры белка по его первичной структуре. Той же проблеме посвящены и исследования В. В результате этих исследований установлено, что образование длинных спирален возможно внутри глобулы из участков, содержащих гидрофобные группы. Спиральными будут также участки молекулы, расположенные на поверхности глобулы, если их гидрофобные радикалы направлены внутрь глобулы, а гидрофильные находятся в контакте с водой. [44]
Белки, а-спираль - пространственное расположение последовательности аминокислот ( один из вариантов вторичной структуры белка), при котором полипептид образует регулярную спираль о шагом 5 44 А и диаметром 10 5 А. На каждый виток о-спирали приходится по 3 7 аминокислотного остатка, а на один аминокислотный остаток - 1 5 А длины спирали. Между атомом водорода в каждой пептидной группировке и карбонильным атомом кислорода третьей по счету от нее аминокислоты возникают внутрицепочечные водородные связи, направленные вдоль оси спирали. Водородные связи появляются после образования спиральной структуры, закрепляют ее и стабилизируют. [45]
Страницы: 1 2 3 4