Третичная структура - белок
Cтраница 3
Легко образующиеся при окислении меркаптогрупп дисульфидные мостики играют важную роль в образовании третичной структуры белков. [31]
В свою очередь, а-спираль может занимать определенное положение в пространстве, которое определяет третичную структуру белка. [32]
Различная проницаемость ионообменных смол для молекул белков использована с целью изучения изменчивости размеров молекул при нарушении третичной структуры белков в процессе разрыва дисульфидных связей при восстановлении тиогликолевой кислотой. [33]
Во-первых, функциональные группы, которые связывают атомы металлов в белках, могут быть сближены в третичной структуре белка, а в цепи белка разделены несколькими аминокислотными остатками. Такие функциональные группы действуют сравнительно независимо одна от другой. Каждая подчиняется геометрическим требованиям, налагаемым цепью белка, находящейся в непосредственной близости к ней, и вследствие контакта с другими функциональными группами координируется к тому же атому металла. Эти ограничения входят в число свойств, которые мы хотели бы изучить, но их трудно воспроизвести в малых модельных соединениях именно потому, что лиганды являются малыми молекулами. Даже в самой простой аминокислоте, глицине, расстояние между концевыми NH2 - и СОО - группами составляет всего несколько ангстрем, а в самом простом пептиде, глицилглицине, кроме этих двух концевых, есть еще пептидная СО-NH-группа. [34]
Электрохимическая структура второй группы белков может быть оценена двояко: или противоположно заряженные функциональные группы в третичной структуре белков расположены на больших расстояниях, или же при близком расположении противоположно заряженных групп рядом с ними находится третья группировка, несущая заряд, нейтрализующий группировку, которая могла бы вызвать явление кулоновского отталкивания. [35]
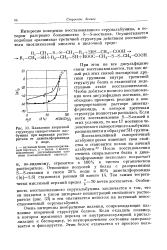 |
Плавление вторичной ловеческого сывороточного альбумина. [36] |
При этом не все дисульфидные связи восстанавливаются, так как целый ряд этих связей маскирован другими группами внутри третичной структуры белка и становится недоступным атаке восстановителями. Чтобы добиться полного восстановления всех дисульфидных мостиков, необходимо проводить реакцию в концентрированном растворе диметил-формамида, в котором третичная структура полностью распалась. [37]
Организованная определенным образом во вторичную структуру молекула белка затем укладывается в компактную, плотную структуру, называемую третичной структурой белка. В ее образовании участвуют как регулярные ( спирализованные или р-складчатые), так и аморфные участки полипептидной цепи. В некоторой степени третичная структура белков отражена в системе классификации белков, основанной на их растворимости в водных средах и являющейся более ранней по сравнению с уже упоминавшейся системой деления белков по продуктам их гидролиза ( см. с. В этом варианте классификации различают глобулярные белки, растворимые в воде и водных растворах кислот, оснований и солей, и фибриллярные белки, нерастворимые в этих растворителях. Третичная структура фибриллярных белков характеризуется нитевидностью ( лат. Цепи фибриллярных белков группируются друг около друга в виде протяженных пучков и отличаются очень большим числом межцепочечных водородных связей. Такие молекулы нерастворимы в воде, так как растворение требует высоких энергетических затрат на разрыв водородных связей, и очень прочны, поэтому они являются основным строительным материалом живых тканей ( например кератины, коллаген, эластин, миозин, фиброин и пр. [38]
Белок может определять природу и число координированных ионом металла лигандов, если энергия взаимодействия между аминокислотными остатками в третичной структуре белка ( а если необходимо, то и между полипептидом и такими лигандами, как порфирин) больше, чем энергия взаимодействия между полипептидом и ионом металла. [39]
 |
Спектры ЭПР сывороточного альбумина, спии-меченного 2 2 5 5-тетраметил - 3-малеимидопир-ролидин - 1-оксидом ( стрелками отмечены широкие компоненты сильно иммобилизованных свободных радикалов. [40] |
Учитывая ранее упомянутые предположения о механизме сильной иммобилизации парамагнитной метки, можно прийти к выводу, что даже небольшие изменения третичной структуры белков могут приводить к существенному изменению подвижности свободных радикалов. [41]
Неупорядоченная структура характерна только для отдельных фрагментов цепи, которые чаще всего появляются между спирализованными и складчатыми участками в ходе формирования третичной структуры белка. [42]
Ленты р-кератина, по-видимому, не сливаются во вторичные спирали, а располагаются в пучке слоями или образуют различные клубки Все эти более сложные комплексы а-спиралей или цепочек р-типа представляют третичную структуру белка. [43]
Между отдельными группами вторичной структуры белков могут также образовываться внутримолекулярные водородные связи, в результате чего отдельные участки спирали сближаются, молекулы изгибаются и свертываются в клубок или складываются - формируется третичная структура белка. В ее образовании большую роль шрают также межмолекулярные взаимодействия полярных групп аминокислот, которые локализуются на внешней поверхности молекул и образуют водородные связи с водой. А гидрофобные ( неполярные) группы находятся внутри молекулы и не имеют контакта с водой. Часть пептидной цепи, которая не образует спирали, содержит аминокислоты с отрицательным зарядом. [44]
Между отдельными группами вторичной структуры белков могут также образовываться внутримолекулярные водородные связи, в результате чего отдельные участки спирали сближаются, молекулы изгибаются и свертываются в клубок или складываются - формируется третичная структура белка. В ее образовании большую роль играют также межмолекулярные взаимодействия полярных групп аминокислот, которые локализуются на внешней поверхности молекул и образуют водородные связи с водой. А гидрофобные ( неполярные) группы находятся внутри молекулы и не имеют контакта с водой. Часть пептидной цепи, которая не образует спирали, содержит аминокислоты с отрицательным зарядом. [45]
Страницы: 1 2 3 4