Адсорбция - белок
Cтраница 1
Адсорбция белков и других биологических полимеров чрезвычайно сложна, поскольку в ней участвуют водородные связи с группами ОН, NH или СО, ионные связи через четвертичные аммониевые ионы, присутствующие в некоторых разновидностях белков, и в особенности связи гидрофобной природы, возникающие между сегментами протеиновых цепей и зависящие от их конфигурации. [1]
Для адсорбции белков достаточно перемешать раствор после добавления геля до получения однородной суспензии. После центрифугирования осадок отбрасывают, если ставилась задача адсорбировать балластные белки. Для элюции фермента используют слабощелочной буферный раствор более высокой концентрации, чем тот, что использовался при промывании геля. [2]
В результате адсорбции белков, которые при каждом вводе пробы достигают капилляра, силанольные группы на стенках капилляра, ответственные за ЭОП, все более и более блокируются. По этой причине ЭОП замедляется, и ионы движутся к детектору медленнее. Уменьшение скорости движения напрямую отражается на площади пиков. С увеличением времени миграции ионы медленнее проходят через детектор, из-за чего площадь пиков растет. [3]
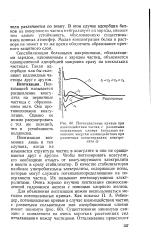 |
Потенциальные кривые при взаимодействии частиц с развитыми сольватньгаи слоями ( показано изменение энергии взаимодействия при различных концентрациях электролита с. [4] |
В этом случае адсорбция белков на поверхности частиц нейтрализует их заряды, снижая тем самым устойчивость, обусловленную существованием ионных атмосфер. Малая концентрация белка в растворе не может в то же время обеспечить образование прочного защитного слоя. [5]
На гидроксилированной поверхности кремнезема адсорбция белков происходит практически необратимо. Необходимо резко снизить адсорбцию белков, сохранив возможность смачивания водными растворами. [7]
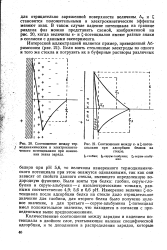 |
Соотношение между термодинамическим, и электрокинетическим потенциалами при изменении знака заряда.| Соотношение между е - и. - потен. [8] |
Измерение величин - потенциала после адсорбции белка на стекле дало отрицательное значение для глобина, для второго белка было получено нулевое значение, а для третьего - серум-альбумина - потенциал имел положительное значение, что находится в согласии с приведенными выше предположениями. [9]
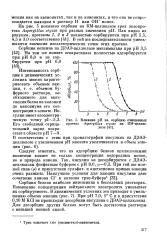 |
Влияние рН на сорбцию очищенных протеаз Aspergillus oryzae на КМ-целлюлозе. [10] |
Следует отметить, что на адсорбцию белков целлюлозными ионитами влияет не только концентрация водородных ионов, но и природа аниона. При той же ионной силе ( [) в присутствии сульфат - и ацетатионов кривые элюции очень размыты. [11]
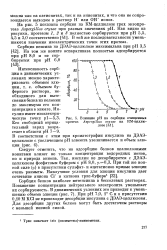 |
Влияние рН на сорбцию очищенных. [12] |
Следует отметить, что на адсорбцию белков целлюлозными ионитами влияет не только концентрация водородных ионов, но и природа аниона. [13]
В кислой области рН ( рН2) адсорбция белков также может уменьшаться вследствие протонирования силанольных групп и устранения тем самым отрицательного заряда поверхности. В данном случае проблемы представляют очень малый ЭОП и возможная денатурация белков. Использование крайних значений рН для анализа биополимеров ограничивает селективность системы, поскольку разница в зарядах анализируемых веществ заметно уменьшается. [15]
Страницы: 1 2 3 4