Адсорбция - пиридин
Cтраница 2
 |
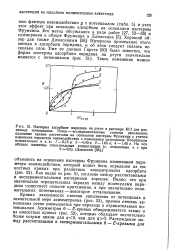
Гидрогенизация пиридина в пиперидин над никелем. а - прямая Аррениуса, . 19 5 ккал / моль. б - прямая Френкеля, Кр-А г 7 5 ккал / моль. [16] |
Френкеля - разность теп-лот адсорбции пиридина и пиперидина, которая находится равной 7 5 ккал / моль. [17]
Экспериментальные данные по теплотам адсорбции пиридина декатионированными цеолитами весьма противоречивы. [18]
Кислотная активация резко увеличила адсорбцию пиридина у обоих бентонитов, особенно у розового ( емкость до проскока - 14 %, полная - 17 4 %), фенола ( 4 и 6 % до проскока и 7 5 % полная емкость), нафтеновых кислот у розового бентонита ( 4 % до проскока и 6 % полная емкость), в то же время активность к смолистым компонентам изменилась мало. [19]
Интересно применение этого метода к адсорбции пиридина, и об этом следует сказать несколько слов. [21]
Аналогичные опыты были проведены по адсорбции пиридина на поверхности алюмосиликата. Поглощение в этой области не является результатом проявления колебаний с участием атомов азота, скорее оно связано с колебаниями, в которых принимают участие атомы углерода цикла. [22]
Согласно i [351, 352], при адсорбции пиридина на цеолите ( Ni Na) - X катионы № 2 не переходят из экранированных позиций в большие полости. Как показано в [353], если пиридин адсорбируется на цеолитах ( Ni Na) - X при повышенных температурах ( 200 С), то в электронных спектрах наблюдаются полосы, характерные для пиридинатов никеля; таким образом, процесс перемещения ионов Ni2 в большие полости требует определенной энергии активации. К тому же, как показано в [350], и само число катионов № 2, заселяющих призмы в цеолите ( Ni Na) - Y, снижается с уменьшением температуры предварительной дегидратации. [23]
Льюисовские центры, обнаруживаемые после адсорбции пиридина, образуются также при откачивании цеолитов CuY при температуре выше 350 С. [24]
С увеличивается в 60 раз при адсорбции пиридина в количестве двух молекул на большую полость и только в 2 раза при адсорбции толуола. [25]
Были исследованы ИК-спектры катализаторов до и после адсорбции пиридина. На рис. 1 и 2 приведены полученные спектры. Спектры, показанные на рис. 1, в, были сняты по двухлучевой схеме ( компенсация фона осуществлялась катализатором, не обработанным парами пиридина); спектры, показанные на рис. 1, а, и 2, получены по однолучевой методике с введением компенсирующей сетки в пучок сравнений. Спектры расположены в порядке возрастания температуры прокаливания. В спектре катализатора, полученного прокаливанием при 800 С, не обнаружено хорошо различимых линий вследствие небольшой поверхности этого образца. [26]
Кислотная активация резко увеличила у обеих разновидностей адсорбцию пиридина, фенола, нафтеновых кислот, в то время как активность к смолистым компонентам изменилась мало. [27]
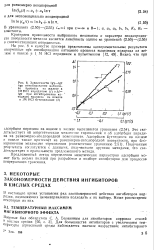 |
Зависимости Igv-IgT при иигибпровании катодного процесса на железе в 1MHCI пиридином ( / и Д ( - IgT при ингибировании катодного процесса на никеле в IM HCI бутиндиолом ( 2. [28] |
Это свидетельствует об энергетическом механизме торможения и об адсорбции пиридина на равномерно-неоднородной поверхности. Полученные результаты согласуются с данными, полученными другими методами, что свидетельствует о правильности предложенного метода. [29]
Однако в работе [89] отмечено, что при адсорбции пиридина на образце декатионированного цеолита Y, откачанного при 450 С, полностью исчезают полосы поглощения 3643 и 3742 см-1, а полоса поглощения 3540 см-1 уменьшается в интенсивности. [30]
Страницы: 1 2 3 4 5