Возможность - образование - связь
Cтраница 2
Наличие неподеленной электронной пары у атома N обуславливает возможность образования донорно-акцсптор-ной связи. [16]
Наличие свободной электронной пары у атома азота обуславливает возможность образования донорно-акцспторной связи. Водные растворы аминов обладают щелочной реакцией. [17]
Силы межмолекулярных связей растворителя и пленкообразующего приблизительно равны; в этом случае появляется возможность образования связей между молекулами пленкообразующего и растворителя. Растворение пленкообразующего становится возможным, но это еще не означает, что оно произойдет. [18]
Эти атомы должны, согласно основному постулату, находиться на расстояниях, обеспечивающих возможность образования связи между ними, и в определенный момент времени должны соприкасаться с атомами катализатора. Реальные размеры атомов таковы, что несколько реагирующих атомов молекулы при контакте с поверхностью не могут разместиться на одном атоме катализатора. Эти предпосылки приводят к выводу, что притяжения и адсорбция многоатомной молекулы должны осуществляться не одним атомом, а группой атомов катализатора - мультиплетом. [19]
В общем можно сказать [176], что ионы металла будут катализировать реакции при условии, что существует возможность образования внутрикомплексной связи. [20]
Выше уже было сказано, что эти соли состоят из ионов, упакованных в основном таким же способом, как в нормальных оксисолях с возможностью образования гидроксильной связи между группами ОН и атомами О оксиионов. Кроме того, так как радиус иона F - очень близок к радиусу О -, то группы ОН могут замещаться F - без заметного изменения структуры. Гидроксиапатит Са3 ( ОН) ( РОД, изоморфен с Са5Р ( РОД. Хотя нелегко представить себе геометрию сложной кристаллической структуры из простой схемы, все же мы привели план структуры Си, ( ОН) As64, г. к как он показывает по крайней мере общее строение этих гидрокн-солей. [21]
Перечеркнутые области между атомами фтора и ксенона на рис. 2 показывают, что связи между этими атомами препятствует принцип Паули, заштрихованные области - что спиновая поляризация обеспечивает возможность образования связи. Сравнение всех четырех фигур рис. 2 свидетельствует о возможном резонансе между структурами и соответствующем понижении энергии системы. [22]
Уменьшение выходов илидов при переходе к арилзамещенным и сильно разветвленным диазо карбонильным соединениям, по-видимому, объясняется тем, что, во-первых, объемные заместители затрудняют подход образующегося кар-бена к атому серы в сульфиде; во-вторых, введение арильных групп снижает элэятрофильность нарбена, и, таким образом, уменьшается возможность образования илидной связи. Введение арильной группы в сульфид снижает его ну-нлеофильность. Существенное значение имеет также стабильность ( термическая и фотохимическая) образующихся илидов и конкурирующие реакции. Увеличение объема заместителей или напряженности цикла у сульфидов, очевидно, приводит к дестабилизации молекулы илида и разложению ( или перегруппировкам) его уже в ходе реакции. [23]
Проанализировать, как влияют перечисленные факторы на растворимость одного вещества в другом: высокая энергия кристаллической решетки растворяемого вещества ( если берется вещество в твердом состоянии); относительно сильное вандерваальсовское взаимодействие между молекулами растворяемого вещества; молекулами растворителя; молекулами растворенного вещества и молекулами растворителя; возможность образования водородных связей между частицами растворенного вещества и растворителя; возможность образования донорно-акцеп-торных связей между частицами растворенного вещества и растворителя; возможность электростатического взаимодействия между частицами растворенного вещества и растворителя; количества растворяемого вещества и растворителя; температура и давление. [24]
Другим серьезным недостатком этой теории является то, что, рассматривая электронную конфигурацию только комплексообразователя, она не учитывает изменения электронной конфигурации лигандов. Отметим прежде всего возможность образования связей более высокого порядка - двойных или тройных, обозначаемых обычно как л-связи. Так как возникновение последних в большой степени зависит от конкретной электронной структуры лиганда, то их существование не может быть описано в рамках теории кристаллического поля. [25]
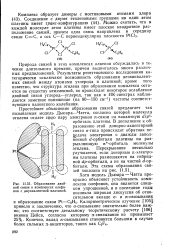 |
Образование двойной связи в комплексах олефинов с двухвалентной платиной. [26] |
Результаты рентгеновского исследования категорически исключают возможность образования неэквивалентных связей между атомами углерода и платиной; кроме того известно, что структура этилена при образовании комплекса остается по существу неизменной, но происходит некоторое ослабление двойной связи углерод-углерод, так как в ИК-спектрах наблюдается заметное понижение ( на 80 - 150 см -) частоты соответствующего валентного колебания. [27]
Таким требованиям отвечает ряд функциональных групп, например азот - и серусодержащие. Наиболее эффективны галогенсодержащие группы, поскольку их лабильность обеспечивает возможность образования химических межфазных связей с адгезивом, содержащим, например, группы с атомами азота. Атомы галогенов достаточно легко ввести в состав субстрата. [28]
ОН дают воду и частично окисленную поверхность. При этом температура преимущественно влияет на изменение про должительности жизни хемосорбированной HNO, причем низкие температуры способствуют большей продолжительности жизни и увеличивают возможность образования связи N - N. Однако совсем не обязательно, чтобы закись азота образовалась в качестве промежуточного соединения раньше окиси азота. Далее, по-видимому, наиболее вероятной реакцией, претерпеваемой радикалами HNO, попавшими в газовую фазу, является реакция с кислородом с образованием радикалов ОН и двуокиси азота. [29]
Существования каких-либо соединений в растворах СН3С1 - SnQ4 обнаружено не было. Спектры растворов СН3С1 - SbCl5 согласуются с существованием линейной связи С - С1 - Sb, однако приведенных доказательств недостаточно для того, чтобы исключить возможность образования ангулярной связи, которая по некоторым другим соображениям кажется более вероятной. На основании полученных данных можно предположить, что соединениям СН3С1 - SnCl4 и СН3С1 - SbCl5 лучше соответствует строение слабо поляризованного донор-но-акцепторного комплекса, чем ионной пары. [30]
Страницы: 1 2 3